1.3.3 Výroba vinylchloridu
Vinylchlorid se vyrábí katalytickým rozkladem 1,2-dichlorethanu za teploty 500 °C a tlaku 20 bar podle rovnice
![]()
Najděte stupeň konverze. Pro jednoduchost předpokládejte, že reakční entalpie nezávisí na teplotě, plyny se chovají ideálně a nedochází k žádným parazitním reakcím.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
a) 0,997
Postup
V tabulkách nalezneme reakční Gibbsovy energie pro látky v ideálním plynném stavu. Spočteme rovnovážnou konstantu. Z reakční entalpie nalezené podobným postupem a van't Hoffovy izobary spočteme rovnovážnou konstantu za vyšší teploty. Pro daný tlak pak vypočteme rovnováhu.
Audio

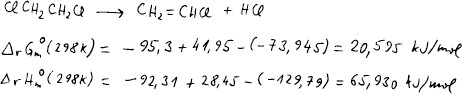
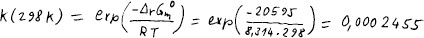
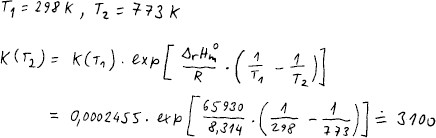
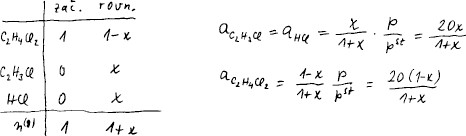
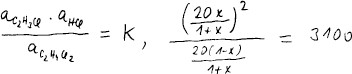
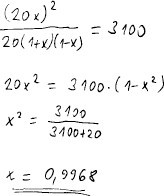
V databázi najdeme entalpii i Gibbsovu energii všech látek ve stavu
ideálního plynu.
Podle Hessova zákona z nich vypočteme reakční Gibbsovu energii a entalpii.
Z Gibbsovy energie vypočteme rovnovážnou konstantu.
Rovnovážnou konstantu přepočteme na vyšší teplotu.
V bilanci vycházíme z jednoho molu dichlorethanu. Ubyde-li x reakčních
obratů dichlorethanu, přibyde po x vinylchloridu a chlorovodíku.
Molární zlomky složek dostaneme dělením celkovým látkovým množstvím plynů
n(g). Aktivita je molární zlomek krát relativní tlak.
Napíšeme podmínku rovnováhy a dosadíme získané aktivity.
Po několika jednoduchých úpravách dostaneme řešení rovnice a výsledný rozsah
reakce.