1.8.3 Faradayův zákon – vylučování kovů, coulometr na třaskavý plyn
Do roztoku chloridu zlatitého byl zaveden stejnosměrný proud. V sériově zapojeném coulometru na třaskavý plyn se při tlaku 96 kPa a teplotě 24 °C vyloučilo 42 cm3 třaskavého plynu. Určete hmotnost vyloučeného zlata (M = 197 g mol−1). Tlak nasycené vodní páry má při uvedené teplotě hodnotu 2,97 kPa.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
138,5 mg zlata
Postup
Faradayův zákon nejprve aplikujeme na třaskavý plyn, zjistíme prošlý náboj a po druhé aplikaci Faradayova zákona spočteme množství zlata.
Audio
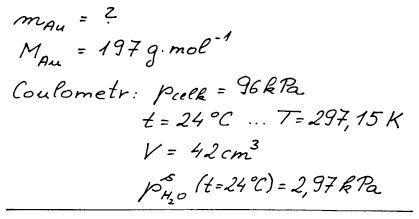
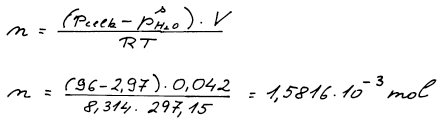
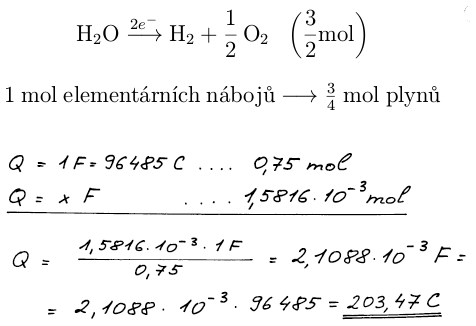
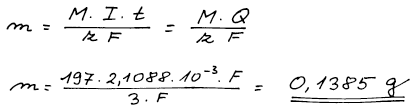
Coulometry slouží ke zjištění náboje, který projde
obvodem. V coulometru na třaskavý plyn probíhá elektrolýza a prošlý
náboj se zjišťuje měřením objemu vyloučeného plynu.
Ke zjištění počtu molů třaskavého plynu využijeme stavovou
rovnici ideálního plynu. Je třeba si uvědomit, že skutečný tlak plynu
je menší než celkový naměřený tlak nad roztokem, protože nad roztokem
je i vodní pára. Předpokládáme, že parciální tlak vodní páry se rovná
tenzi par při dané teplotě.
Platí, že nábojem 1 Faraday se vyloučí 0,75 mol třaskavého plynu.
Známe-li náboj, který prošel elektrolytem, tak z Faradayova zákona lze
vypočítat hmotnost vyloučeného zlata. Zlatité ionty během elektrolýzy
získávají 3 elektrony a tak z = 3.