1.2.1 Příprava roztoků
Zjistěte kolik vody a methanolu (v gramech) je třeba k přípravě 1000 g kapalné směsi methanolu(2) a vody(1) následujícího složení: a) w2=0,1, b) x2=0,1, c) ϕ2=0,1, d) c2=2 mol/dm3 při 20 °C. V posledním případě předpokládejte, že při míšení látek nedochází ke změně objemu.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
a) m1 = 100 g, m2 = 900 g , b) m1 = 834,994 g, m2 = 165,006 g ,
c) m1 = 919,061 g, m2 = 80,939 g,
d) m1 = 934,704 g, m2 = 65,296 g.
Postup
a) m = 1000 = m1+m2, w2 = m2/m ,
b) m = n1M1+n2M2, ni = mi/Mi, x2 = n2/(n1+n2) ,
c) V = m1/ϱ1•+m2/ϱ2•, ϕ2 = m2/ϱ2•/[m1/ϱ1•+m2/ϱ2•] ,
d) c2 = (m2/M2)/[m1/ϱ1•+m2/ϱ2•] .
M1, M2, ϱ1•, ϱ2• jsou molární hmotnosti
a měrné hustoty obou látek.
Řešení
ad a) Výpočet vychází ze základní bilanční úvahy
![]()
Z rovnice (1.6) a z definice hmotnostního zlomku složky 2
![]()
dostaneme
![]()
ad b) Z definice molárního zlomku složky 2
![]()
kde m1 a m2 jsou hledané hmotnosti vody a methanolu v g. Z rovnic (1.6) a (1.8) dostaneme
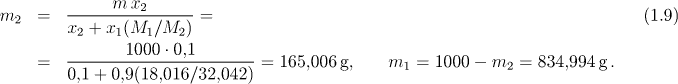
ad c) Objemový zlomek ϕ2 je definován vztahem
![]()
Řešením rovnic (1.6) a (1.10) získáme
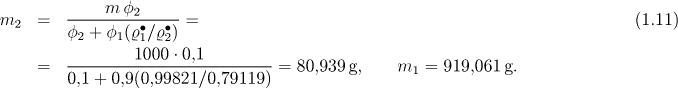
ad d) Látková koncentrace složky 2 (dříve se používalo označení molarita) je definována vztahem
![]()
kde V je v cm3. Tento objem určíme na základě aproximace (deklarované v zadání příkladu)
![]()
Řešením soustavy rovnic (1.6), (1.12) a (1.13) obdržíme

Poznámka
2. V potravinářském průmyslu jsou často objemová procenta definovaná vztahem ϕi = 100(Vi•/V), v takovém případě však neplatí relace ∑ϕi = 1.