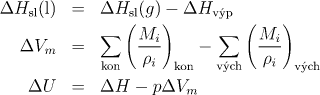3.4.9 Výpočet změny entalpie a vnitřní energie při chemické reakci v plynném a kapalném stavu
Na základě následujících dat vypočtěte standardní změnu entalpie a
vnitřní
energie při hydrataci ethylenoxidu na glykol. Reakce
C2H4O+ H2O = C2H6O2
probíhá při 25 °C a tlaku 101,325 kPa. Výpočet proveďte pro
případ, že všechny látky jsou v plynné (platí stavová rovnice
ideálního plynu) nebo v kapalné fázi. Na základě získaných hodnot
určete procentický rozdíl mezi změnou entalpie a vnitřní energie.
Data:

↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
a) C2H4O(g) + H2O(g) = C2H6O2(g)
ΔH°1 = −94,893 kJ/ mol, ΔU°1 = −97,732 kJ/ mol,
rozdíl 2,61%.
b) C2H4O(l) + H2O(l) = C2H6O2(l)
ΔH° = −95,893 kJ/ mol, [ ΔV = −13,34 cm3 mol−1 ] , ΔU° = −95,892 kJ/ mol,
rozdíl 0,001 %. Tento rozdíl se obvykle zanedbává.
Postup
Pro výpočet změny vnitřní energie reakce v plynném stavu použijte vztahy
![]()
U výpočtu pro reakci v kapalině je nutné přepočítat slučovací entalpie z plynného na kapalný stav. Proto použijte vztahy