7.2.1 Výpočet standardního redukčního potenciálu
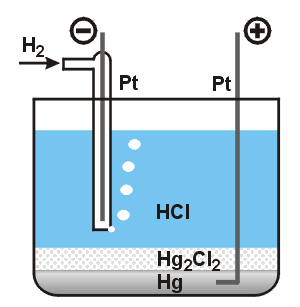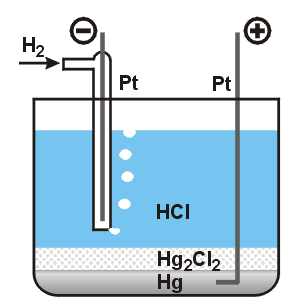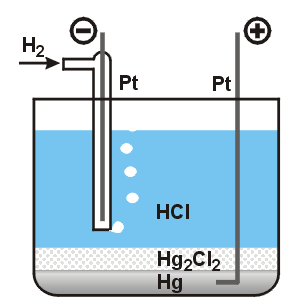
Článek, sestavený z kalomelové a vodíkové elektrody
![]()
má při teplotě 25 °C elektromotorické napětí 0,3859 V. Vypočítejte standardní redukční potenciál kalomelové elektrody. Předpokládejte ideální chování vodíku. Standardní stav: ideální plyn za tlaku f° = 101,325 kPa.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
EHg2Cl2/Hg/Cl−° = 0,268 V
Řešení
Elektromotorické napětí článku je rovno algebraickému
součtu všech potenciálových rozdílů v článku.
Závislost potenciálů obou elektrod na aktivitách reagujících
látek se řídí Nernstovou rovnicí.
Na levé (záporné) elektrodě probíhá reakce
![]()
Pro potenciál levé elektrody platí Nernstova rovnice (7.18)
![]()
Standardní potenciál vodíkové elektrody EH+/H2 je nulový, a pro aktivitu vodíku za předpokladu ideálního chování platí
![]()
Pravá (kladná) elektroda je elektrodou druhého druhu. Elektrodové reakci
![]()
odpovídá Nernstova rovnice ve tvaru
![]()
Tuhý chlorid rtuťný (kalomel) a kapalná rtuť jsou čisté látky, nemísí se s ostatními složkami v článku. Jsou proto ve svých standardních stavech a jejich aktivita je jednotková. Spojením obou rovnic pro potenciály elektrod dostaneme pro elektromotorické napětí článku vztah
![]()
Poznámka: Elektromotorické napětí článku je možno vyjádřit také jako rozdíl redukčních potenciálů pravého a levého poločlánku:
![]()
Protože pro střední iontovou aktivitu kyseliny chlorovodíkové platí
![]()
dostaneme pro standardní potenciál kalomelové elektrody rovnici
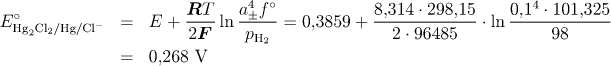
Hodnotu střední iontové aktivity elektrolytu získáváme zpravidla z koncentrace elektrolytu, která je experimentálně dostupná, a z hodnoty středního aktivitního koeficientu, kterou můžeme vypočítat např. z Debyeova-Hückelova zákona.Tento vztah však platí přesně pouze pro silně zředěné roztoky. Proto se při velmi přesných měřeních zjišťuje hodnota standardního redukčního potenciálu pro různé koncentrace elektrolytu a výsledky se extrapolují na nekonečné zředění.