3.3.1 Adiabatická vratná a nevratná expanze
Jeden mol ideálního plynu expandoval adiabaticky z počátečního
stavu p1 = 200 kPa, V1 = 20 dm3 na konečný tlak p2 =
100 kPa těmito způsoby:
a) vratně,
b) nevratně proti stálému tlaku p2.
Vypočítejte v obou případech konečný stav systému a vykonanou
práci. Molární tepelná kapacita uvažovaného plynu je C°pm =
29 J mol−1 K−1.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
a) Vm2 = 32,79 dm3 T2 = 394,4 K W = − 1793,5 J
b) T2 = 412,1 K W = − 1426 J
Řešení
Nejdříve vypočítáme ze stavové rovnice počáteční teplotu
![]()
a ze zadané hodnoty C°pm poměr tepelných kapacit
![]()
a) V případě vratné adiabatické expanze dosazením do Poissonovy rovnice (3.15) získáme
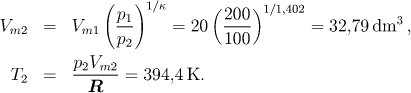
Podle I. věty termodynamické (event. dosazením do rovnice (3.14) ) získáme
![]()
b) Pro případ, že p = p2 = konst. dostaneme z I.věty termodynamické
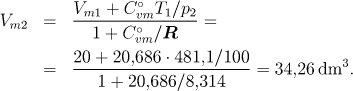
Ze stavové rovnice ideálního plynu získáme
![]()
a pak
![]()