1.1.1 Molární hmotnost plynu
![]() Baňka o objemu 250 cm3 naplněná za teploty 25 °C a tlaku 95 kPa
neznámým oxidem dusíku váží 45,555 g. Tatáž baňka otevřená váží za týchž
podmínek 45,411 g. Molární hmotnost vzduchu je 29 g mol−1.
Baňka o objemu 250 cm3 naplněná za teploty 25 °C a tlaku 95 kPa
neznámým oxidem dusíku váží 45,555 g. Tatáž baňka otevřená váží za týchž
podmínek 45,411 g. Molární hmotnost vzduchu je 29 g mol−1.
a) Jaká je molární hmotnost plynu?
b) Určete, o jaký oxid dusíku se jedná.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
a) 44 g/mol, b) N2O
Postup
Prázdná baňka je vlastně baňka naplněná vzduchem. Odečtením plné a prázdné baňky dostaneme rozdíl hmotností plynu a vzduchu a ze stavové rovnice ideálního plynu pak molární hmotnost.
Audio
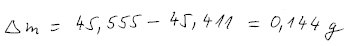
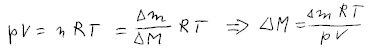
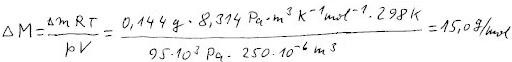
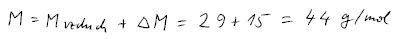
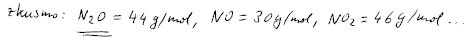
Prázdná baňka je vlastně baňka naplněná vzduchem. Odečtením plné a prázdné
baňky dostaneme rozdíl hmotností plynu a vzduchu.
Ve stavové rovnici dosadíme za látkové množství n a upravíme, abychom
dostali molární hmotnost plynu, v našem případě ovšem rozdíl od vzduchu.
Pozor na jednotky! Pokud dosazujeme v základních jednotkách vše kromě
hmotnosti delta m, dostaneme výsledek v gramech na mol.
Po přičtení molární hmotnosti vzduchu dostaneme molární hmotnost neznámého
plynu.
Zkusíme několik nejjednodušších oxidů dusíku a zjistíme, že v baňce byl
rajský plyn – oxid dusný.