1.2.1 Syntéza NO
Syntéza oxidu dusnatého probíhá katalytickou oxidací amoniaku za teploty 1160 K podle rovnice:

↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
−7,5 GJ (teplo nutno odvést)
Postup
Vstupující látky i produkty mají stejnou teplotu, a proto použijeme Kirchhofův vzorec.
Audio
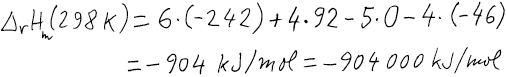
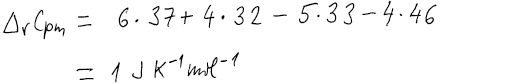
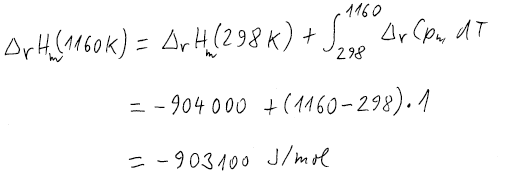
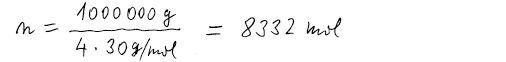
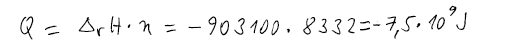
Vstupující látky i produkty mají stejnou teplotu, a proto použijeme
Kirchhofův vzorec.
Nejprve vypočteme z Hessova zákona reakční entalpii za standardní teploty
298 K.
Pak potřebujeme změnu tepelných kapacit látek při reakci.
Integrál ze změny tepelných kapacit v zadaných mezích přičteme k reakční
entalpii za standardní teploty.
Takto vypočtená entalpie je na 1 mol reakčních obratů. Při reakci ale vzniknou
4 moly oxidu dusnatého. Při výpočtu proto dělíme 4, abychom dostali počet molů
reakčních obratů nutných k výrobě jedné tuny NO.
Výsledné teplo má záporné znaménko, a proto je nutno ho odvést (reakce je
exotermická).