1.2.2 Hoření železa
 V povídce V. Steklače "Fialová příšera" zapálili nezbední žáci
hasicí přístroj na chodbě a ten shořel jasným plamenem. Za
předpokladu, že hasicí přístroj byl prázdný a byl zapálen autogenem
v čistém kyslíku (jinak železo nehoří), vypočtěte teplotu, které bylo
dosaženo. Předpokládejte, že železo se oxiduje stechometrickým
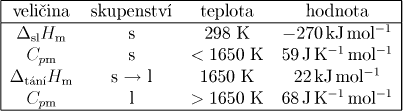
množstvím kyslíku na FeO a reakce probíhá adiabaticky. Data pro FeO:
V povídce V. Steklače "Fialová příšera" zapálili nezbední žáci
hasicí přístroj na chodbě a ten shořel jasným plamenem. Za
předpokladu, že hasicí přístroj byl prázdný a byl zapálen autogenem
v čistém kyslíku (jinak železo nehoří), vypočtěte teplotu, které bylo
dosaženo. Předpokládejte, že železo se oxiduje stechometrickým
množstvím kyslíku na FeO a reakce probíhá adiabaticky. Data pro FeO:
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
4124 K
Postup
Teplo vzniklé reakcí, Q2 = −270 kJ mol−1, plus teplo Q3 potřebné na ohřátí produktu (FeO) se má rovnat nule (podmínka adiabatického průběhu). Při výpočtu Q3 integrujeme tepelnou kapacitu nejprve FeO(s) od 298 K do bodu dání, přičteme entalpii tání, a integrujeme FeO(l) do konečné teploty T. Z podmínky Q2+Q3 = 0 vypočteme T.
Audio
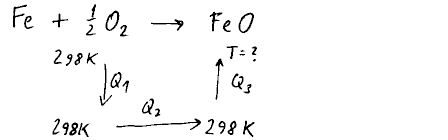
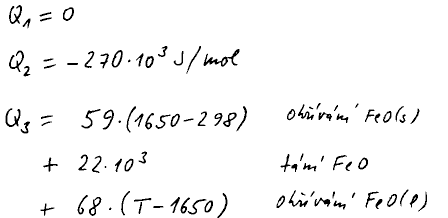
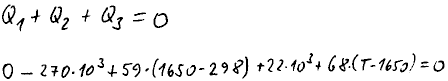
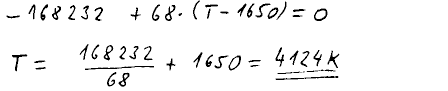
Vycházíme z obecného schématu entalpické bilance.
Slučovací entalpie látek jsou známy při teplotě 298 K.
Teplo potřebné k přechodu vstupujících látek na tuto teplotu je označeno Q1.
Reakční teplo při "tabulkové" teplotě 298 K je označeno Q2.
Teplo potřebné k ohřevu produktů na neznámou konečnou teplotu T je
označeno Q3.
Protože teplota vstupujících látek je rovna právě "tabulkové" teplotě
298 K, je první teplo Q1 rovno nule.
Teplo Q2 je rovno zadané slučovací entalpii.
Při výpočtu Q3 integrujeme tepelnou kapacitu nejprve FeO(s) od 298 K do
bodu dání, přičteme entalpii tání, a integrujeme FeO(l) do konečné teploty T.
Podmínka pro adiabatický průběh reakce je, že součet tepel je roven
nule.
Vznikne lineární rovnice, kterou snadno vyřešíme.