1.7.1 Výpočet rovnovážné konstanty ze složení rovnovážné směsi
Cyklohexanol se vyrábí katalytickou hydrogenací fenolu podle rovnice
![]()
Při studiu této reakce za atmosférického tlaku a teploty 500 K byla
do reaktoru dávkována směs 1 mol fenolu a 6 mol vodíku. Rovnovážná
směs obsahovala 12,7 mol.% produktu. Vypočítejte rovnovážnou konstantu
a standardní reakční Gibbsovu energii ![]() této reakce pro standardní stav pst = 101,325 kPa, jestliže se plyny
chovají ideálně.
této reakce pro standardní stav pst = 101,325 kPa, jestliže se plyny
chovají ideálně.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
K = 3,493 (ξ = α(fenol) = 0,6437)
Postup
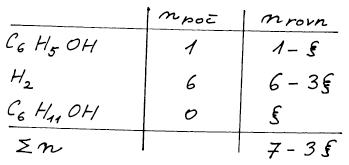
Pro výpočet rovnovážné konstanty potřebujeme molární zlomky všech látek v rovnováze. Ty vypočteme na základě bilance.
Audio
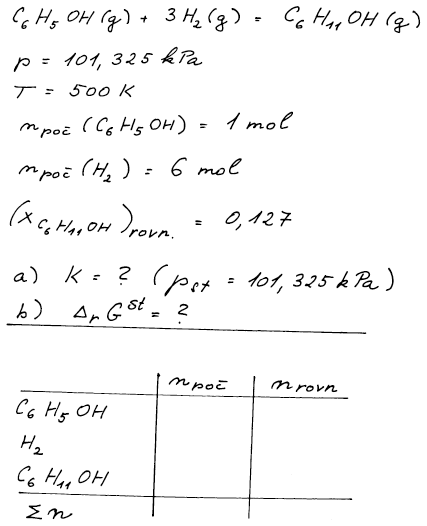
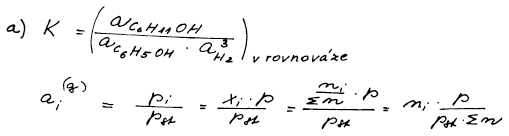
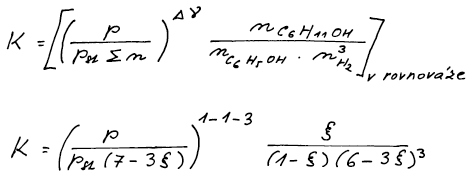
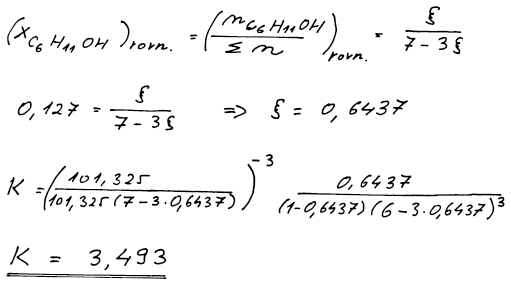
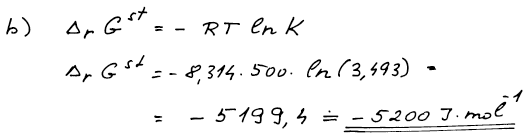
Řešení každého příkladu z chemické rovnováhy by mělo začínat látkovou
bilancí nejlépe ve formě tabulky. Bilancujeme počty molů všech
přítomných plynných látek na vstupu do reaktoru a
v rovnováze. V tabulce zavedeme pojem rozsah reakce ξ, který vyjadřuje
počet molů zreagovaného fenolu. Tabulku ještě doplníme řádkou
vyjadřující celkový počet molů.
Na počátku máme 1 mol fenolu, předpokládáme, že ho zreaguje ξ molů a
tak v rovnováze zůstane (1−ξ) molů fenolu. Ať do reaktoru vstupuje
jakékoli množství vodíku (stechiometrické množství, přebytek) vždy
zreaguje 3ξ molů vodíku a v rovnováze nám tedy zůstane (6−3ξ) molů
vodíku. Z ξ zreagovaných molů fenolu bude v rovnováze ξ molů
cyklohexanolu.
Pro rovnovážnou konstantu platí vztah vyjádřený pomocí aktivit
reagujících látek v rovnováze. Naší snahou je převést aktivity na
měřitelné veličiny tj. např. na počty molů v rovnováze, které máme
vyjádřeny v bilanční tabulce.
Vztah pro rovnovážnou konstantu upravíme pro standardní stav čisté
plynné složky za teploty systému a standardním tlaku pst = 101,325 kPa. Δν zde
vyjadřuje součet stechiometrických koeficientů plynných produktů mínus
součet stechiometrických koeficientů plynných výchozích látek.
Pro výpočet K je třeba zjistit rozsah reakce ξ. Ten vypočteme z údaje
o rovnovážném složení (tj. z molárního zlomku) produktu. Takto
vypočtený rozsah reakce ξ dosadíme do rovnice pro výpočet K.
Chemická rovnováha je propojena s klasickou termodynamikou vztahem
mezi rovnovážnou konstantou K a standardní reakční Gibbsovou
energií. Pouhým dosazením získáme hledanou hodnotu 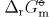 .
.