1.7.2 Výpočet rovnovážného složení z rovnovážné konstanty
Rovnovážná konstanta hydrogenace propenu na propan má za teploty 1050 K hodnotu 0,3 (pro standardní stav pst = 101,325 kPa). Vypočítejte složení rovnovážné směsi v molárních procentech, jestliže reakce probíhá za atmosférického tlaku a molární poměr propenu a vodíku v nástřiku je 1:1. Předpokládejte ideální chování složek.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
46,726 mol.% propenu a vodíku; 6,547 mol.% propanu (ξ = α = 0,1229 )
Postup
Molární zlomky látek určené z bilance obsahují jednu neznámou – rozsah reakce. Ten určíme z podmínky rovnováhy.
Audio
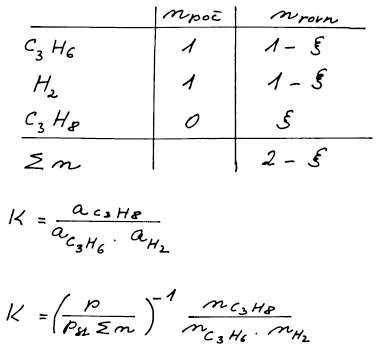
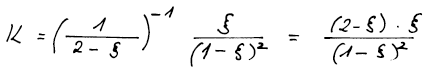
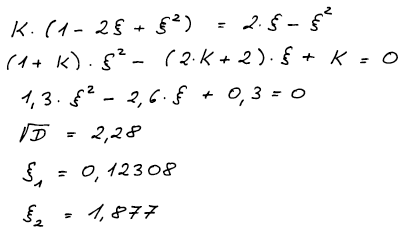
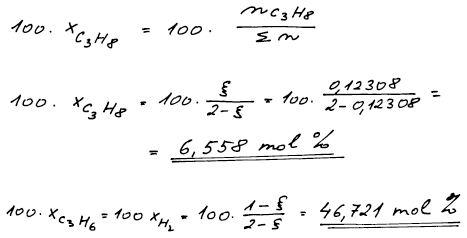
Nejprve si sestavíme bilanční tabulku a pak si připravíme vztah pro
rovnovážnou konstantu pomocí počtu molů všech plynných složek
v rovnováze.
Ze zadání příkladu známe rovnovážnou konstantu reakce a zajímá nás
složení směsi v rovnováze. To znamená, že ze vztahu pro K chceme
vypočítat rozsah reakce ξ a pak dopočítat rovnovážná molární procenta
přítomných látek.
Po úpravě rovnice pro K dostaneme kvadratickou rovnici, jejímž řešením
je rozsah reakce ξ. Řešením vlastně získáme dva kořeny, jeden z nich
ale nemá fyzikální význam. Z toho jak jsme si zvolili ξ v bilanční
tabulce vyplývá, že naše ξ může ležet jen v intervalu od nuly do
jedné.
Molární zlomky v rovnováze vypočteme z jejich definice s využitím
údajů z bilanční tabulky a s použitím vypočteného ξ. Molární procenta
získáme vynásobením molárních zlomků stem.