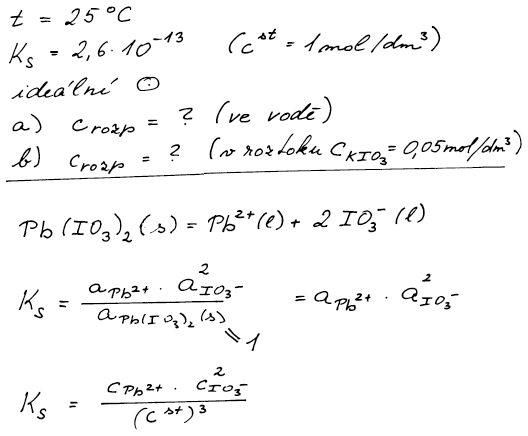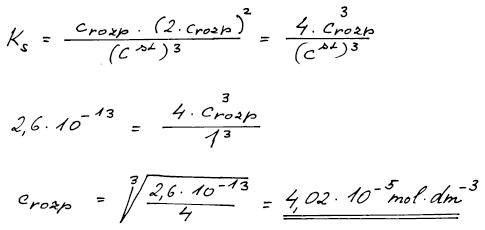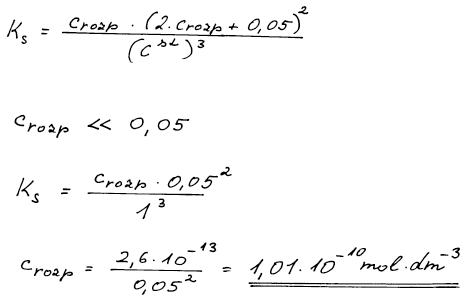1.7.7 Součin rozpustnosti
Sraženina jodičnanu olovnatého má být při teplotě 25 °C promývána:
(a) čistou vodou, nebo
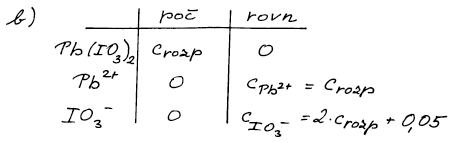
(b) roztokem KIO3 o koncentraci 0,05 mol dm−3.
Vypočítejte rozpustnost Pb(IO3)2 pro oba tyto případy.
Jaký promývací
roztok vede k nejmenším ztrátám sraženiny? Součin rozpustnosti
jodičnanu olovnatého je 2,6 . 10−13 (cst = 1 mol dm−3). Hydrolýzu olovnatých iontů zanedbejte.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
(a) 4,02 . 10−5 mol dm−3 ; (b) 1,04 . 10−10 mol dm−3
Výhodnější je promývání roztokem KIO3.
Pozn.: ionty Pb2+ jsou ve skutečnosti mírně kyselé a hydrolyzují podle rovnice
Pb2+ + H2O → PbOH+ + H+ (pKa = 6.2),
což zde způsobí nepatrné zvýšení rozpustnosti v čisté vodě na
4,19 . 10−5 mol dm−3; výsledek případu (b) není prakticky
ovlivněn.
Postup
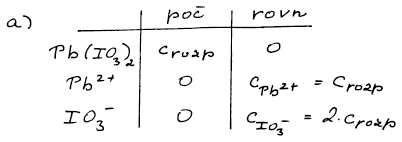
Součin rozpustnosti je rovnovážná konstanta disociace iodičnanu na ionty. Provedeme bilanci a vypočteme. U případu (b) lze zjednodušit výpočet tím, že koncentraci Pb2+ lze proti koncentraci iodičnanu zanedbat.
Audio