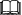2.18 Hessův zákon
Pomocí Hessova zákona lze
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
d) určit standardní reakční entalpie
Řešení
Hessův zákon umožňuje výpočet standardní reakční entalpie reakce
např. ze standardních slučovacích tepel jednotlivých látek (![]() ).
).
![]()
kde νi jsou stechiometrické koeficienty při matematickém zápisu chemické reakce (záporné pro výchozí látky, kladné pro produkty). Uvedený vztah je také možno převést na součet dvou tepel
![]()
Hessův zákon je příklad využití stavového charakteru entalpie. Hodnota stavové veličiny
(reakční entalpie) není závislá na "cestě" systému z výchozího do konečného stavu.
Výpočet reakční entalpie je tudíž prováděn
pro hypotetickou reakční cestu: za dané teploty a standardního
tlaku se výchozí látky nejprve rozloží na prvky (viz teplo Q1) a poté se
z těchto prvků vytvoří produkty (viz teplo Q2).
Rozkladu látky na prvky, resp.
jejímu složení z prvků, přísluší standardní
slučovací entalpie ![]() . Její hodnota pro rozklad a pro složení se liší pouze znaménkem,
které je v Hessově zákoně zohledněno pomocí stechiometrických koeficientů νi.
. Její hodnota pro rozklad a pro složení se liší pouze znaménkem,
které je v Hessově zákoně zohledněno pomocí stechiometrických koeficientů νi.
Jinou alternativou Hessova zákona je výpočet standardní reakční entalpie pomocí spalných tepel
(![]() ).
).
![]()