4.3.1 Výpočet absolutní entropie ze III. věty termodynamiky
S použitím dále uvedených dat vypočítejte absolutní molární entropii
jednoklonné síry při teplotě 373,15 K a tlaku 101,325 kPa.
Síra existuje v kosočtverečné krystalické
modifikaci do teploty 368,46 K, potom přechází na síru
jednoklonnou. Teplo této fázové přeměny má hodnotu 0,4017
kJ/mol. Normální teplota tání jednoklonné síry je 388,36 K a
molární teplo tání má hodnotu 1,717 kJ/mol.
Hodnoty molárních tepelných kapacit ( J mol−1 K−1):
Kosočtverečná síra v intervalu 20 až 298,15 K:
| T/ K | 20 | 40 | 60 | 80 | 100 | 150 | 200 | 250 | 298,15 |
| Cpm | 2,57 | 6,08 | 8,72 | 10,9 | 12,8 | 16,62 | 19,41 | 21,31 | 22,60 |
![]()
Jednoklonná síra v intervalu 368,46 až 388,36 K:
![]()
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ΔSm0 → 20 = 0,8567 J mol−1 K−1
ΔSm20 → 298,15 = 30,826 J mol−1 K−1
ΔSm298,15 → 368,46 = 5,018 J mol−1 K−1
ΔSmkos. → jedn. =1,090 J mol−1 K−1
ΔSm368,46 → 373,15 = 0,325 J mol−1 K−1
![]() = 38,116 J mol−1 K−1
= 38,116 J mol−1 K−1
Řešení
Podle třetí věty termodynamiky je absolutní entropie
kosočtverečné síry při absolutní nule nulová. Absolutní
entropie síry je tedy
rovna součtu dílčích změn entropie při přechodu ze stavu
![]() = 0 K; 101,325 kPa) do stavu
(
= 0 K; 101,325 kPa) do stavu
(![]() = 373,15 K; 101,325 kPa).
= 373,15 K; 101,325 kPa).
1. Ohřev kosočtverečné síry z absolutní nuly do teploty
modifikační přeměny.
Protože je v tomto teplotním rozsahu molární tepelná kapacita
zadána různými způsoby (Debyeův vztah, tabulka a polynom),
změnu entropie při tomto pochodu vyjádříme jako součet tří dílčích
hodnot: změny entropie v intervalu 0 až 20 K, změny entropie
v intervalu 20 až 298,15 K a změny entropie při ohřevu od 298,15 K do
bodu zvratu.
Pro interval 0 až 20 K využijeme Debyeova vztahu (4.20)
![]()
Konstantu a vypočítáme porovnáním této rovnice s hodnotou molární tepelné kapacity při teplotě 20 K (první hodnota v tabulce v zadání):
![]()
Pro změnu entropie získáme hodnotu
![]()
Hodnotu změny entropie při ohřevu z teploty 20 K na teplotu 298,15 K vypočítáme z tabelovaných hodnot molární tepelné kapacity numerickou integrací pomocí lichoběžníkového pravidla. Hodnota změny entropie je dána vztahem
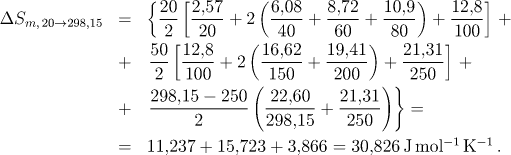
Změnu entropie při ohřevu z 298,15 K na teplotu modifikační přeměny vypočítáme analytickou integrací
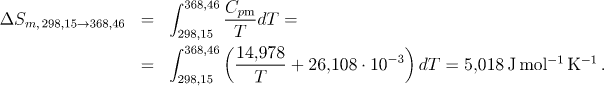
2. Přeměna kosočtverečné síry na jednoklonnou. Jde o izotermicko-izobarickou fázovou přeměnu. Pro změnu entropie proto platí (molární teplo modifikační přeměny dosazujeme v J/mol):
![]()
3. Ohřev jednoklonné síry na konečnou teplotu. Změnu entropie vypočítáme analogicky jako u síry kosočtverečné:
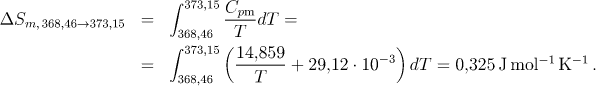
Celková změna entropie, která je dána součtem všech dílčích změn, zároveň představuje hodnotu absolutní entropie síry při daných podmínkách
![]()
Analogickým způsobem by bylo možno pokračovat, až bychom získali absolutní entropii ve stavu ideálního plynu.