4.4 Termodynamika reálných tekutin
Pro výpočet změny vnitřní energie s objemem za stálé teploty se u reálného plynu používá vztah
![]()
a pro izotermní změnu entalpie s tlakem platí

Změnu entropie s teplotou a tlakem je nutno vypočítat podle obecné rovnice (4.6) a změnu s teplotou a objemem podle rovnice (4.7). Pro závislost molárních tepelných kapacit na tlaku nebo na objemu platí vztahy
![]()
![]()
Pro Jouleův-Thomsonův koeficient platí
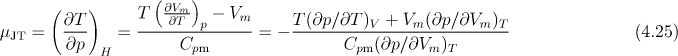
Fugacita je definována Lewisovým vztahem
![]()
Mezi tlakem a fugacitou platí vztah
![]()
kde φ označuje fugacitní koeficient, daný vztahem
![]()
Symbolem z je označen kompresibilitní faktor.
Příklady:
4.4.1 Výpočet ΔU, ΔH a ΔS pomocí van der Waalsovy rovnice (4.4.2 Isobarická změna entropie s objemem pro ideální plyn a van der Waalsovu rovnici (
4.4.3 Výpočet změny entropie s tlakem pro různé modely stavového chování plynu (
4.4.4 Změna Gibbsovy energie s tlakem (
4.4.5 Změna U, S, F při izotermní expanzi (
4.4.6 Změna entalpie s tlakem (
4.4.7 Cv,Cp a Jouleova-Thomsonova koeficientu pro reálný plyn (
4.4.8 Výpočet molární tepelné kapacity za vyššího tlaku (
4.4.9 Odhad Jouleho-Thomsonova koeficientu u methanu (
4.4.10 Výpočet inverzní teploty za nízkého tlaku (
4.4.11 Výpočet inverzní teploty z teplotní závislosti II.viriálního koeficientu (
4.4.12 Výpočet fugacity čisté látky (
4.4.13 Výpočet fugacity (
4.4.14 Výpočet fugacity u viriální tlakové rovnice (