7.1.10 Stanovení molární elektrické vodivosti
Při měření konduktivity roztoku síranu lanthanitého o koncentraci 0,01 mol dm−3 byl odpor vodivostní nádobky 68 Ω, při kalibraci nádobky pomocí roztoku chloridu draselného o koncentraci 0,01 mol dm−3 měl naměřený odpor hodnotu 327 Ω. Vypočítejte molární elektrickou vodivost měřeného roztoku. Konduktivita roztoku KCl (c = 0,01 mol dm−3) je 0,1413 S m−1, konduktivita použité vody 1,6.10−5 S m−1.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
κroztok = 0,6795 S m−1 ![]() = 6,795.10−2 S m2mol−1
= 6,795.10−2 S m2mol−1
Řešení
Nejprve vypočítáme konduktivitu síranu lanthanitého v roztoku. Platí vztah (7.4):
![]()
kde
![]()
Protože je konduktivita použité vody o několik řádů
menší nežli konduktivita roztoku, je možné její
vliv zanedbat a konduktivitu samotného síranu lanthanitého
nahradit konduktivitou roztoku.
Síran lanthanitý disociuje podle rovnice
![]()
Pro molární vodivost rozpuštěného elektrolytu platí vztah (7.5):
![]()
kde κ je konduktivita roztoku (S m−1) a c je
koncentrace La2(SO4)3 v roztoku (mol dm−3).
Ekvivalentová vodivost, s níž se setkáme ve
starší literatuře, je dána vztahem
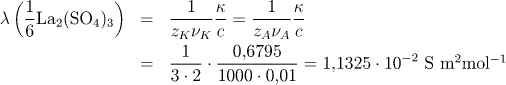
Do všech vztahů pro výpočet konduktivity je nutné dosazovat molární koncentraci ve správných jednotkách, tj. v mol m−3.