1.4.3 Změna entropie při ohřevu spojeném s fázovým přechodem
Vypočítejte změnu entropie při izobarickém přechodu 27 g ledu o teplotě 0 °C na vodu o teplotě 20 °C. Teplo tání ledu je 6,008 kJ mol−1, molární tepelná kapacita kapalné vody je 75,3 J K−1 mol−1, M = 18 g mol−1.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ΔS = 40,974 J K−1, (ΔtáníS = 32,993 J K−1, ΔohřevS = 7,981 J K−1)
Postup
Sečteme změny entropie obou procesů.
Audio
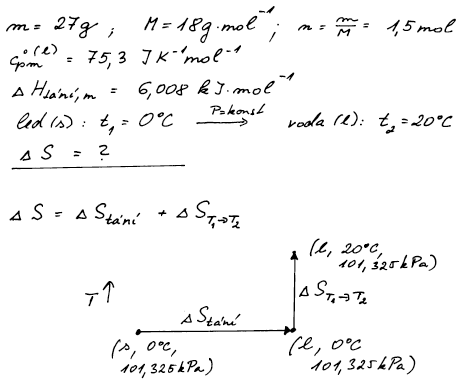
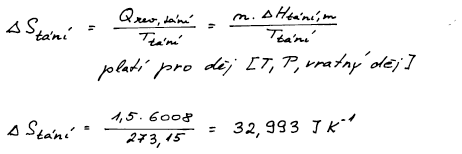
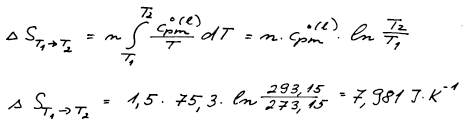
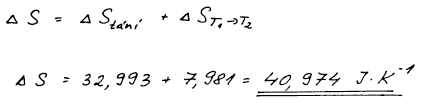
Entropie je stavová veličina a její změna závisí jen na počátečním a
konečném stavu. Pro výpočet celkové změny entropie si můžeme děj
rozdělit na dva kroky - prvním z nich je vratný fázový přechod ledu na
vodu při 0 °C a tlaku 101,325 kPa. Druhý děj bude vlastní ohřev vody
z T1 na T2.
Změnu entropie vratného fázového přechodu vypočteme přímo z II.věty
termodynamické. Fázový přechod se uskutečňuje za konstantní T a P a
tak teplo vratně vyměněné s okolím můžeme nahradit změnou entalpie
fázového přechodu.
Změnu entropie pro izobarický ohřev kapalné vody vypočteme z teplotní
závislosti entropie za konstantního tlaku.
Celková změna entropie je kladná, což souhlasí s představou, že kapaliny
jsou méně uspořádané než tuhé látky.