1.4.4 Směšovací entropie a Gibbsova energie
Najděte celkovou změnu entropie a Gibbsovy energie při smíšení 0,1 dm3 kyslíku a 0,4 dm3 dusíku při 17 °C a tlaku 101,325 kPa. Předpokládejte ideální chování.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ΔS = 0,087 J/K
Postup
Použijeme vzoreček pro ideální směšovací entropii. Z definice pak dostaneme i Gibbsovu energii
Audio
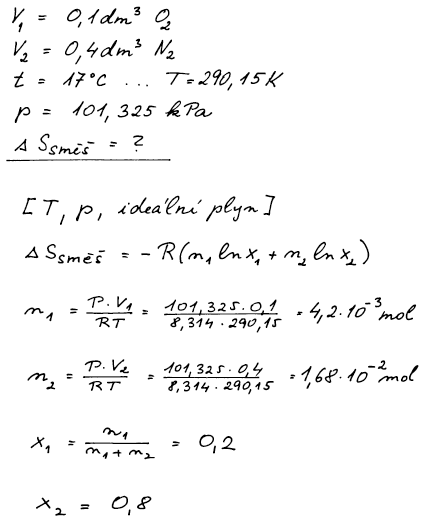
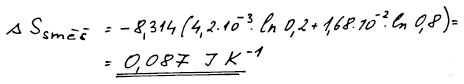
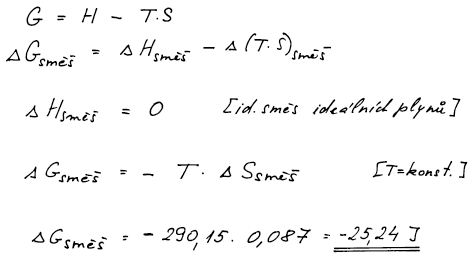
Dva ideální plyny se za konstantní teploty a tlaku mísí a vzniká
ideální směs. Změna entropie tohoto nevratného děje se nazývá
směšovací entropie. Směšovací entropie u ideálních plynů nezávisí ani
na teplotě ani na tlaku, ve vztahu pro výpočet se objevují pouze počty
molů čistých složek a molární zlomky ve vzniklé směsi.
Směšovací entropie musí být kladná, neboť se jedná o nevratný děj.
Při výpočtu změny Gibbsovy energie při směšování vyjdeme z definice
této funkce. Směšovací entalpie ideální směsi ideálních plynů je
rovna nule.