1.4.5 Entropie binární směsi
Vypočtěte molární entropii systému, který obsahuje 0,2 mol kyslíku a
0,8 mol dusíku při teplotě 25 °C a při tlacích: (a) 101,32 kPa, (b)
200 kPa. Absolutní entropie čistých látek při 25 °C a tlaku 101,325
kPa jsou:
Sm(O2) = 205,029 J K−1 mol−1,
Sm(N2) = 191,481 J K−1 mol−1.
Předpokládejte ideální chování.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
(a) Sm = 198,351 J K−1
(b) Sm = 192,697 J K−1
Postup
Vypočteme směšovací entropii a přičteme obě složky. U (b) musíme přidat změnu s tlakem.
Audio
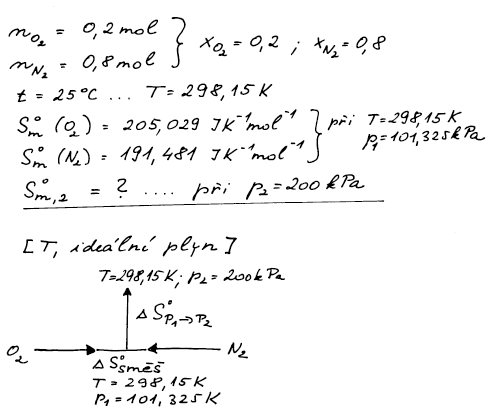
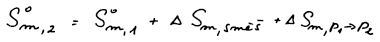
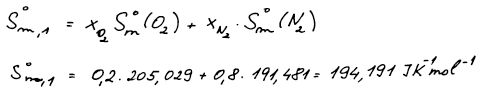
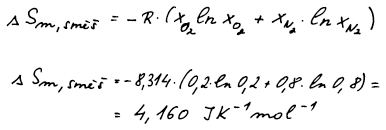
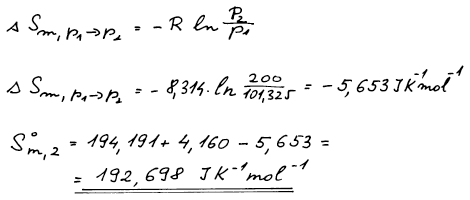
Cílem je vypočítat absolutní entropii směsi kyslíku a dusíku za tlaku
p2 = 200 kPa. Máme zadány absolutní hodnoty molárních entropií obou
čistých složek. Zvolíme si cestu, po které se dostaneme z bodu 1 do
konečného bodu 2. Cesta může být například: oba plyny smísíme při T a
p1 a pak směs stlačíme na tlak p2.
Celkovou absolutní molární entropii získáme jako součet absolutní
molární entropie čistých plynných složek + směšovací entropie + změna
entropie doprovázející změnu tlaku z p1 na p2.
Absolutní molární entropie obou čistých látek na počátku.
Molární směšovací entropie – počty molů v původním vztahu vystřídaly
molární zlomky.
Změna entropie 1 molu směsi ideálních plynů s tlakem za konstantní T.