1.4.6 Změna entropie při adiabatickém směšování
Dva moly vody o teplotě 350 K byly adiabaticky smíchány při stálém tlaku s jedním molem vody o teplotě 290 K. Vypočtěte celkovou změnu entropie doprovázející tento děj. Předpokládejte, že molární tepelná kapacita vody Cp,m° = 75,25 J K−1 mol−1 je nezávislá na teplotě.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ΔS = 0,8677 J K−1 (výsledná teplota při směšování T = 330 K)]
Postup
Nejprve spočítejte výslednou teplotu (kalorimetrická rovnice). Změna entropie je součtem změn entropie dvou dějů: ohřevu jedné části a ochlazení druhé části. (Nepleťte s ideální směšovací entropií, která se týká směšování různých látek při stejné teplotě!)
Audio
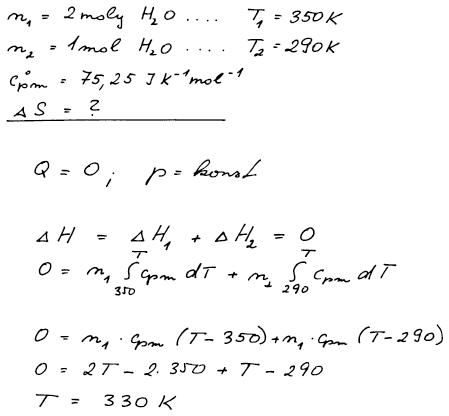
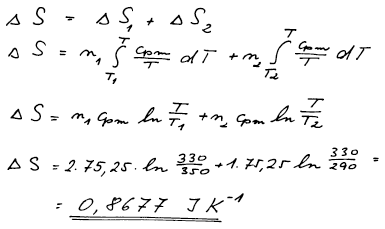
Adiabatický děj za konstantního tlaku. Je třeba vypočítat výslednou
teplotu po smíšení teplé a studené vody T, na které se systém
ustálí. Provedeme bilanci entalpií (teplo vyměněné za konstantního
tlaku), když víme, že celková změna entalpie je nulová (adiabatický
děj).
Celková změna entropie bude součtem změny entropie související
s ochlazením teplejší vody a změny entropie doprovázející ohřátí
chladnější vody na výslednou teplotu T. Při výpočtu se nesmí objevit
příspěvek směšovací entropie!!!!! Nejedná se o pravé směšování dvou či
více látek. Molekuly vody teplejší i chladnějčí jsou stejné částice a
po smíšení nelze určit, zda částice pochází z první nebo z druhé vody.