1.6.4 Raoultův zákon – výpočet parní fáze
Na základě dále uvedených teplotních závislostí tlaku nasycených par
benzenu(1) a toluenu(2) a za předpokladu platnosti Raoultova a
Daltonova zákona vypočtěte tlak par a složení parní fáze nad roztokem
obsahujícím 60 mol.% benzenu, který vře při teplotě 90 °C.
Data:
ln (p1s/kPa) = 13,88581 2788,5/(t / °C+ 220,8)
ln (p2s/kPa) = 13,99562 3094,5/(t / °C+ 219,4)
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
p = 103,4 kPa, v páře je 79 mol.% benzenu a 21 mol.% toluenu
Postup
Nejprveme spočteme tlaky nasycených par obou látek a pak použijeme kombinaci Raoultova a Daltonova zákona
Audio
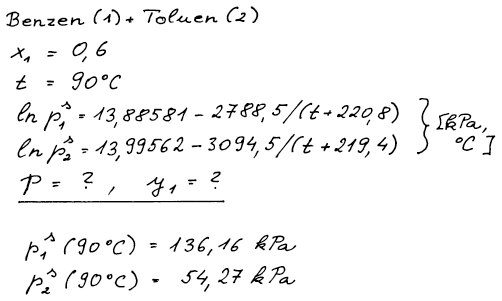
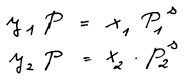
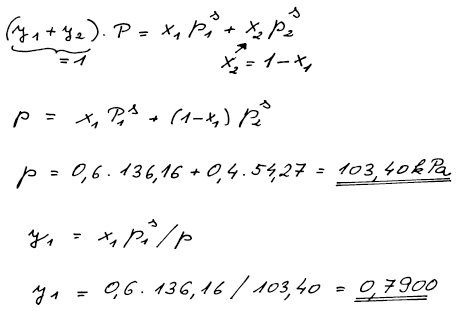
Izotermní rovnováha kapalina-pára binárního systému. Známe-li teplotu,
můžeme ze zadaných Antoineových rovnic vypočítat tenzi par obou
čistých látek za rovnovážné teploty 90 °C.
Rovnováhu kapalina-pára směsi, u které předpokládáme ideální chování
kapalné i parní fáze, vystihuje Raoultův zákon. U binárního systému
jsou to dvě rovnice.
Známe rovnovážné složení kapalné fáze a tenze par obou čistých
látek. Řešením dvou rovnic vypočteme dvě neznámé: rovnovážný tlak a
rovnovážné složení parní fáze.