1.6.6 Raoultův zákon – výpočet rovnovážného složení
Vypočítejte složení kapalné fáze a parní fáze, které jsou v rovnováze
u systému acetonitril(1) – nitromethan(2) při 60 °C za tlaku 33,5
kPa.
Tenze par čistých látek:
p1s = 49,1 kPa, p2s = 23,8 kPa.
Předpokládejte platnost Raoultova a Daltonova zákona.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
x1 = 0,383, y1 = 0,562
Postup
Kombinace Raoultova a Daltonova zákona vede k soustavě dvou rovnic o dvou neznámých.
Audio
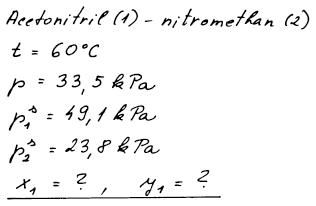
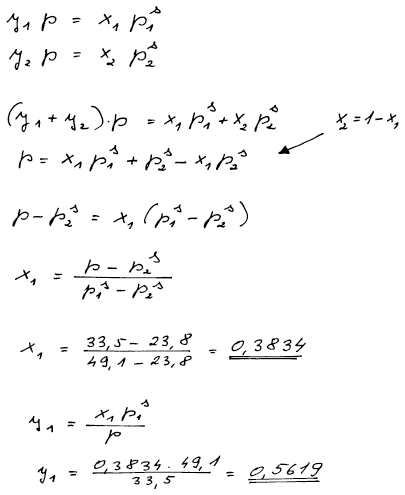
Rovnováha kapalina-pára, binární směs, ideální chování kapalné i parní fáze (= platí Raoultův a Daltonův zákon).
Kombinací Raoultova a Daltonova zákona získáme pro každou složku rovnici vyjadřující rovnováhu mezi kapalnou a parní fází. Máme tedy dvě rovnice pro dvě neznámé – molární zlomek kapalné a molární zlomek parní fáze v rovnováze.
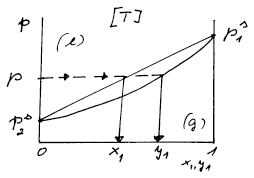
Situaci si můžeme načrtnout do obrázku závislosti tlaku na složení obou fází a výsledky můžeme porovnat s tímto obrázkem. V tomto příkladě je zřejmé, že musí plati y1 > x1.