6.1.12 Ovlivnění rovnovážného složení celkovým tlakem
Rovnovážná konstanta syntézy amoniaku z prvků
![]()
má při teplotě 600 K hodnotu 1,585 . 10−3 pro standardní stav
f° = 101,325 kPa. Reakce probíhá při molárním poměru vodíku k dusíku
v nástřiku 3:1. Vypočítejte obsah amoniaku v rovnovážné
směsi za předpokladu: (a) ideálního chování, (b) reálného chování
plynů aproximované Lewisovým–Randallovým pravidlem pro případy:
1. Reakce probíhá za tlaku 101,3 kPa.
2. Reakce probíhá za tlaku 16 MPa a
fugacitní koeficient vodíku má za uvedených podmínek
hodnotu 1,042.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
a1)1,26 mol.% a2)50,34 mol.% b1)1,23 mol.% b2)53,85 mol.%.
Postup
Výpočet proveďte pomocí rovnice
![]()
kde Kφ je definováno vztahem:
![]()
Parametr φ představuje fugacitní koeficient.
V případě tlaku 101,3 kPa se plyny chovají ideálně, jejich fugacitní koeficienty jsou jednotkové . Pro tlak 16 MPa získáme fugacitní koeficienty dusíku a amoniaku odečtem z generalizovaného diagramu fugacitních koeficientů; potřebné kritické veličiny najdeme v tabulkách, fugacitní koeficient vodíku je zadán.
Řešení
Ze vztahu (6.2) je zřejmé, že složení rovnovážné směsi bude u reakce
v plynné fázi ovlivněno tlakem pouze
v případě že parametr Δν je nenulový (tedy pro reakce s rozdílnou sumou
stechiometrických koeficientů produktů a výchozích látek). Protože rovnovážná
konstanta zůstává i při změně tlaku stálá(viz volba std. stavu), musí se změnit
poměr látkového množství produktů a výchozích látek. Všimněte si, že tento poměr
lze změnit i ředěním reakční směsi inertem - diskutujte vliv přidání inertu ve
srovnání se zvýšením celkového tlaku.
a) Řešení pro ideální chování plynné směsi
Vztah pro rovnovážnou konstantu uvedené reakce má za předpokladu ideálního chování
plynné směsi tvar
![]()
Jako základ výpočtu zvolíme 1 mol dusíku. Látkovou bilanci uspořádáme do tabulky:

![]()
Tento výraz upravíme tak, abychom při výpočtu rozsahu reakce získali kvadratickou rovnici:
![]()
Ad 1. Dosazením hodnoty rovnovážné konstanty a tlaku p = 101,3 kPa do předchozího výrazu dostaneme:
![]()
Po úpravě rezultuje kvadratická rovnice
![]()
která má řešení ξ = 0,02429. Obsah amoniaku vypočítáme z látkové bilance
![]()
Ad 2. Pro tlak 16 MPa:
![]()
Po úpravě obdržíme
![]()
která má řešení ξ = 0,6697. Obsah amoniaku opět vypočítáme z látkové bilance
![]()
Tlak 16 MPa je samozřejmě příliš veliký na to, aby mohl být přesně vystižen modelem ideálního chování. Nicméně výsledky jasně ukazují, jak může tlak významně ovlivnit výtěžek u plynných reakcí, kde se liší suma stechiometrických koeficientů produktů a výchozích látek (Δν je různé od nuly). Pokud je Δν záporné (stávající případ, suma stechiometrických koeficientů výchozích látek je vyšší než pro produkty), zvýšení tlaku podporuje přeměnu výchozích látek na produkty. Pokud je Δν kladné, je vliv tlaku opačný. Jak veliké chyby jsme se dopustili použitím ideálního modelu pro tlak 16 MPa ukazuje následující řešení.
b) Řešení pro reálné chování plynné směsi
Vztah pro rovnovážnou konstantu má v daném případě tvar:
![]()
kde Kφ je definováno vztahem:
![]()
Parametr φ představuje fugacitní koeficient.
Ad 1. V případě tlaku 101,3 kPa se plyny chovají ideálně, jejich fugacitní koeficienty jsou jednotkové a řešení pro tento tlak je totožné s předchozím postupem.
Ad 2. Pro tlak 16 MPa získáme fugacitní koeficienty dusíku a amoniaku odečtem z generalizovaného diagramu fugacitních koeficientů; potřebné kritické veličiny najdeme v tabulkách, fugacitní koeficient vodíku je zadán.
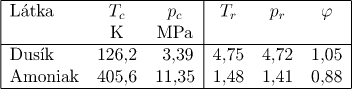
![]()
Za předpokladu platnosti Lewisova-Randallova pravidla nejsou tyto fugacitní koeficienty a tím ani Kφ závislé na složení, ale pouze na teplotě a tlaku. Po dosazení za Kφ do upraveného vztahu pro rovnovážnou konstantu získáme pro tlak 16 MPa výrazy
![]()
Řešením kvadratické rovnice dostaneme rozsah reakce ξ = 0,7. Obsah amoniaku v rovnovážné směsi vypočítáme analogicky, jako v předcházejícím případě:
![]()
Z porovnání této hodnoty a údaje získaného za předpokladu ideálního chování plyne, že zanedbání reálného chování u reakcí za vysokých tlaků vede k chybám ve výsledku.