6.1.40 Rovnovážná konstanta a změna termochemických veličin při reakci
Teplotní závislost rovnovážné konstanty hydrogenace ethylenu na ethan je vystižena rovnicí
![]()
Vypočítejte změnu Gibbsovy energie, reakční entalpii a změnu entropie uvažované reakce při teplotě 1100 K.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ΔG°= -118022 J/mol , ΔH°= - 61224 J/mol , ΔS° = 51,653 J mol−1 K−1 .
Postup
![]()
Řešení
S ohledem na propojení rovnovážné konstanty se změnou standardní Gibbsovy
energie reakce (6.7) a reakční entalpií (6.4), lze spolu
s aplikací spojených formulací I.věty termodynamické využít informací o
rovnovážném složení k určení změn termochemických veličin při reakci.
K výpočtu standardní reakční Gibbsovy energie použijeme vztah
(2,30285 = ln 10)
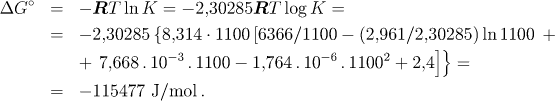
K výpočtu reakční entalpie použijeme upravený vztah (6.4)
![]()
Pro reakční entalpii získáme hodnotu
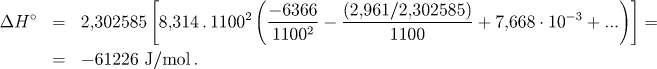
Nakonec vypočítáme změnu entropie při reakci z definičního vztahu pro Gibbsovu energii:
![]()