2.12 Stupeň přeměny 
Uvažujte reakci A → B + 2 C , která probíhá v plynné fázi za konstantní teploty a objemu v uzavřeném systému. Na počátku je pouze látka A o tlaku 100 kPa. Určete celkový tlak při 50% stupni přeměny látky A.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
p = 200 kPa
Řešení
V úloze je nutno řešit bilanci chemické reakce pomocí tlaku. Úlohu lze řešit úvahou, nebo pomocí
bilanční tabulky.
Úvaha:
Stav, kdy zreagovalo 50 % látky A, znamená, že v systému zreagovalo "50 kPa" této výchozí látky.
Její zbytkový parciální tlak je tedy 50 kPa. Dle stechiometrie v systému však přibylo
50 kPa parciálního tlaku látky B a 100 kPa parciálního tlaku látky C. Celkový tlak
je dán součtem všech parciálních tlaků: p = 50+50+100 = 200 kPa.
Řešení pomocí bilanční tabulky:
Sestavíme bilanční tabulku parciálních tlaků všech plynných látek
(i – označení látky, p0,i – počáteční parciální tlak látky i, pi – parciální tlak
při daném stupni přeměny, ξ – rozsah reakce v jednotkách tlaku, νi – stechiometrický koeficient)
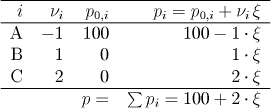
Celkový tlak je dán součtem parciálních tlaků všech plynných složek a určíme ho z rovnice
p = ∑pi = 100+2 . ξ. Pro jeho vyčíslení musíme nejprve vyhodnotit rozsah reakce ξ.
Ten určíme pomocí stupně přeměny látky A, který je v úloze zadán (![]() , resp. α = 0,5). Z definice
stupně přeměny plyne
, resp. α = 0,5). Z definice
stupně přeměny plyne
![]()
Řešením rovnice ξ/100 = 0,5 dostaneme ξ = 50 kPa. Dosazením získané hodnoty do rovnice pro celkový tlak pak p = 100+2 . 50 = 200 kPa .