2.22 Závislost rovnovážné konstanty na teplotě 
Pro látky A, B, C při teplotě 298 K jsou standardní slučovací entalpie
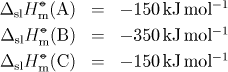
Rovnovážná konstanta chemické reakce A + B → 2 C bude v okolí teploty 298 K:
a) růst s rostoucí teplotou
b) klesat s rostoucí teplotou
c) nebude se znatelně měnit s teplotou
d) nelze rozhodnout, musíme znát hodnotu rovnovážné konstanty při 298
K
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
a) růst s rostoucí teplotou
Řešení
Teplotní závislost rovnovážné konstanty K ve tvaru je dána vztahem
![]()
kde ![]() je standardní reakční entalpie. Její znaménko rozhoduje o tom, zda
derivace na levé straně bude mít kladnou či zápornou hodnotu (jinými slovy, jestli
bude rovnovážná konstanta s teplotou vzrůstat či klesat).
je standardní reakční entalpie. Její znaménko rozhoduje o tom, zda
derivace na levé straně bude mít kladnou či zápornou hodnotu (jinými slovy, jestli
bude rovnovážná konstanta s teplotou vzrůstat či klesat).
![]() určíme pomocí Hessova zákona
určíme pomocí Hessova zákona
![]()
![]()
Z výsledku je zřejmé, že ![]() (endotermická
reakce). Derivace (d ln K/dT) bude tudíž kladná
(rostoucí funkce ln K = f(T)) a rovnovážná konstanta bude růst
s teplotou.
(endotermická
reakce). Derivace (d ln K/dT) bude tudíž kladná
(rostoucí funkce ln K = f(T)) a rovnovážná konstanta bude růst
s teplotou.
Poznámka
Řešení úlohy můžeme rovněž vydedukovat úvahou: Bude-li v reakční
baňce probíhat endotermická reakce, baňka se bude ochlazovat (reakční
systém si odebírá teplo z okolí). V tomto případě reakci podpoříme tím
že, systému budeme dodávat teplo topením (budeme zahřívat).