1.1.1 Hmotnost plynu v tlakové láhvi
 Jaká je hmotnost dusíku v tlakové láhvi o objemu V = 50 dm3,
je-li v ní při teplotě t = 20 °C tlak dusíku p = 15 MPa?
Jaká je hmotnost dusíku v tlakové láhvi o objemu V = 50 dm3,
je-li v ní při teplotě t = 20 °C tlak dusíku p = 15 MPa?
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
m = 8,619 kg
Postup
Látkové množství je dáno vzorcem n = m/M (m = hmotnost plynu, M = molární hmotnost). Dosaďte do stavové rovnice ideálního plynu a z výsledného vztahu vyjádřete neznámou hmotnost m.
Řešení
Ze stavové rovnice ideálního plynu
![]()
kde n = m/M je látkové množství, m hmotnost plynu a M jeho molární hmotnost, R = 8,314 J mol−1 K−1 plynová konstanta a T = t+273,15 K absolutní teplota, dostaneme
![]()
Poznámka
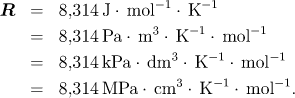
2. Předvedené řešení je poněkud netypickým použitím stavové rovnice ideálního plynu, protože tlak je již poměrně vysoký. V takovém případě obvykle slouží stavová rovnice ideálního plynu jen k získání přibližného odhadu. Teplota dusíku je však relativně vysoká (vzhledem k teplotě kritické), a proto chyba při tomto výpočtu činí pouze 2,4%.