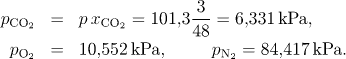1.2.12 Výpočet složení spalin
Propan je spalován dvojnásobným množstvím vzduchu než odpovídá stechiometrii reakce. Za předpokladu, že veškerý propan shoří na oxid uhličitý a vodu, vypočítejte parciální tlak jednotlivých složek ve spalinách, je-li celkový tlak 101,3 kPa. Jaké budou parciální tlaky složek tehdy, jestliže veškerá voda zkondenzuje? Pro jednoduchost předpokládejte, že vzduch se skládá z 80 mol. % dusíku a 20 mol. % kyslíku. Reaktanty i produkty v plynné fázi se řídí stavovou rovnicí ideálního plynu.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledky
pCO2 = 5,845 kPa, pH2O = 7,790 kPa, pO2 = 9,745 kPa, pN2 = 77,92 kPa.
Po kondenzaci vody:
pCO2 = 6,331 kPa, pO2 = 10,552 kPa, pN2 = 84,417 kPa.
Postup
Na základě chemické reakce vypočteme vzniklé množství oxidu uhličitého a vodní páry a potřebné množství vzduchu. Vypočteme molární zlomky složek a potom i parciální tlaky.
Řešení
Spalování propanu si vzhledem k zadání zapíšeme ve tvaru
CH3CH2CH3 + 10 O2 + 40 N2 = 3 CO2 + 4 H2O
+ 5 O2 + 40 N2
Látkovou bilanci nejlépe zachycuje následující tabulka:
| Látka | Počátek reakce | Konec reakce |
| propan | 1 mol | 0 |
| kyslík | 10 mol | 5 mol |
| dusík | 40 mol | 40 mol |
| oxid uhličitý | 0 | 3 mol |
| voda | 0 | 4 mol |
| ∑ | 51 mol | 52 mol |
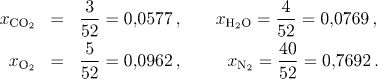
Pro parciální tlak platí rovnice (1.15), takže
![]()
Zkondenzuje-li voda, podílí se na celkovém tlaku spalin pouze zbylé tři složky
![]()
a parciální tlaky budou mít tyto hodnoty: