8.4.1 Vliv teploty na reakční rychlost
Kinetika reakce 2 HI(g) → H2(g) + I2(g) byla sledována Bodensteinem a byly určeny rychlostní konstanty při teplotě T1 = 556 K, k1 = 4,2 . 10−8 min−1 dm3 mol−1 a T2 = 781 K, k2 = 4,7 . 10−3 min−1 dm3 mol−1. Na základě těchto údajů určete: a) aktivační energii této reakce, b) rychlostní konstantu při teplotě 800 K, c) za předpokladu, že se jedná o plynnou reakci II. řádu, vypočtěte za jak dlouho se rozloží první procento HI při 800 K. Počáteční tlak HI je 100 kPa. Předpokládejte platnost stavové rovnice ideálního plynu.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
a) E = 186535 J/mol, b) k = 9,298 . 10−3 min−1 dm3 mol−1, c) τ = 72,13 min.
Postup
Řešení
Známe-li rychlostní při dvou teplotách určíme aktivační energii ze vztahu (8.35)
![]()
Rychlostní konstantu při teplotě 800 K určíme s pomocí získané aktivační energie E ze vztahu
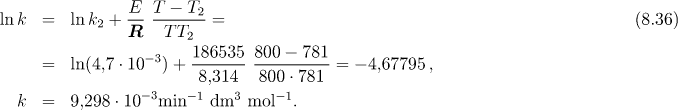
Abychom určili čas potřebný na zreagování 1 % HI musíme určit
počáteční
koncentraci HI. Podle stavové rovnice ideálního plynu dostaneme
cHI,0 = pHI,0/(RT) = 100/(8,314 . 800) = 0,01503 mol/dm3.
Po zreagování 1 % HI bude koncentrace jodovodíku rovna
cHI = cHI,0 . x = 0,0150 . 0,99 = 0,01488 mol/dm3.
Dosazením do rovnice (8.16) získáme
τ = (1/9,298 . 10−3)[1/0,01488−1/0,0150] = 72,13 min.