8.7 Katalýza
Některé látky, aniž by se objevovaly v zápisu chemické reakce, mají schopnost ovlivňovat rychlost chemických reakcí. Pokud takové látky rychlost chemické reakce zvyšují, označujeme je jako katalyzátory, pokud ji zpomalují pak je nazýváme jako inhibitory či stabilizátory (u tuků se např. snažíme potlačit jejich hydrolýzu). V případě homogenní katalýzy je katalyzátor ve stejné fázi jako reakční směs. U heterogenní katalýzy je katalyzátor nejčastěji v tuhé fázi a reakční směs v kapalné či plynné fázi.
U acidobázické katalýzy jsou katalyzátorem přítomné hydroxoniové nebo hydroxylové ionty. Rychlostní konstanta se vyjadřuje vztahem
![]()
Vzhledem k tomu, že se katalyzátor reakce neúčastní, zůstává koncentrace těchto iontů během reakce konstantní a tím i neměnná rychlostní konstanta.
Enzymatická katalýza. V přírodě je řada chemických reakcí umožněna enzymy, které dokáží chemické reakce značně urychlit a reakce může probíhat i za velmi nízkých koncentrací. Formálně můžeme enzymatickou katalýzu zapsat ve tvaru
![]()
kde S je tzv. substrát, látka jež se chemicky přeměňuje na produkt R za katalytického působení enzymu E. Enzymatickou katalýzu popisujeme rovnicí, kterou odvodili Michaelis a Mentenová
![]()
kde cE0 je celková koncentrace enzymu, cS je koncentrace substrátu a KM je tzv Michaelisova konstanta
![]()
která odpovídá rovnovážné konstantě reakce rozpadu komplexu substrát-enzym (standardní koncentrace c° je v rovnici (8.101) často vynechávaná a potom má KM rozměr koncentrace).
![]()
Standardní koncentrace c° je v rovnici (8.101) často vynechávaná a potom má KM rozměr koncentrace. Z rovnice (8.100) plynou dva zvláštní případy
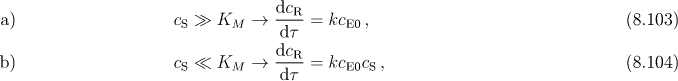
V prvém případě je enzymatická katalýza reakcí 0.řádu vůči substrátu, v druhém I. řádu.
Heterogenní katalýza. V případě heterogenní katalýzy se reakce nejčastěji uskutečňuje na povrchu tuhého katalyzátoru. Pokud je řídícím dějem povrchová reakce
![]()
potom pro rychlost tvorby produktu můžeme psát relaci
![]()
která vyplývá z Langmuirovy izotermy. Podobně jako u enzymatické katalýzy, také zde získáváme dva zvláštní případy
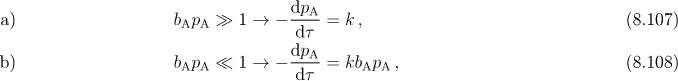
V prvém případě získáváme reakci 0.řádu a v druhém I. řádu. Rovnici (8.106) můžeme integrovat a získali bychom relaci
![]()
Příklady:
8.7.1 Acidobázická katalýza (8.7.2 Vliv snížení aktivační energie (
8.7.3 Acidobázická katalýza, II (
8.7.4 Odbourávání ethanolu v játrech člověka (
8.7.5 Reakce při nízkých koncentracích (
8.7.6 Hydrolýza sacharosy pomocí invertásy (
8.7.7 Katalytický rozklad N2O na Au (
8.7.8 Rozklad HI na Au (