1.3.2 Výpočet tepla a práce při izobarickém ději
Šest gramů vodíku (M(H2) = 2 g mol−1) je pod tlakem 507 kPa při teplotě 273 K. Za nezměněného tlaku vzroste objem na 15 dm3. Vypočtěte pro tento děj práci, teplo, změnu vnitřní energie a změnu entalpie. Předpokládejte, že vodík se chová ideálně.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
W = −795,8 J (n = 3 mol, V1 = 13,43 dm3)
Postup
Spočtěte objemovou práci, aplikujte 1. větu a definici entalpie.
Audio
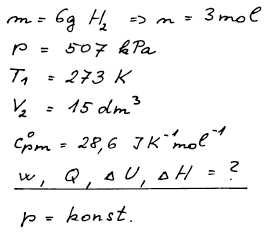
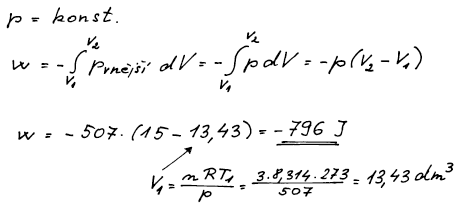
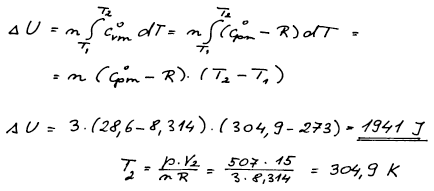
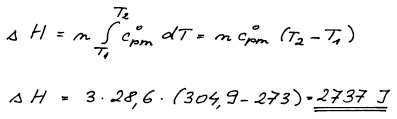
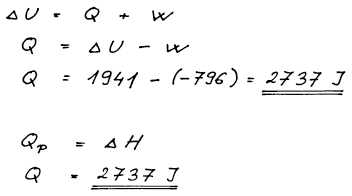
Během děje je tlak uvniř i vně systému stejný a je konstantní –
izobarický děj.
Vnější tlak je konstantní, a proto p můžeme vytknout před integrál
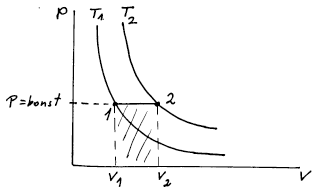
Práci si můžeme zakreslit do obrázku p = f(V) jako plochu pod křivkou,
po které se systém ubírá. Zde je to plocha obdelníka o stranách p a
rozdílu (V2−V1). Vzhledem k tomu, že se jedná o expanzi, tak systém
práci koná a znaménko práce musí být záporné.
Změnu vnitřní energie můžeme počítat buď přímo z 1. věty
termodynamické nebo z teplotní závislosti U. Obecně je vnitřní energie
funkcí teploty a objemu, ale u ideálního plynu závisí jen na teplotě.
Také entalpie ideálního plynu je funkcí pouze teploty.
Teplo vypočteme z 1.věty termodynamické