1.3.4 Adiabatická vratná komprese
Jeden mol ideálního plynu je adiabaticky vratně stlačen ze stavu p1 = 0,1 MPa, T1 = 320 K na trojnásobek původního tlaku. Vypočítejte kompresní práci a změnu entalpie při kompresi. Počítejte s hodnotou Cpm = 34,7 J K−1 mol−1.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
W = 2542,5 J, ΔH = 3343,6 J; κ = 1,3151, T2 = 416,36 K
Postup
Nejprve spočteme teplotu T2 z Poissonových rovnic. Práce je pak rovna změně vnitřní energie, kterou spočteme z rozdílu teplot a CV.
Audio
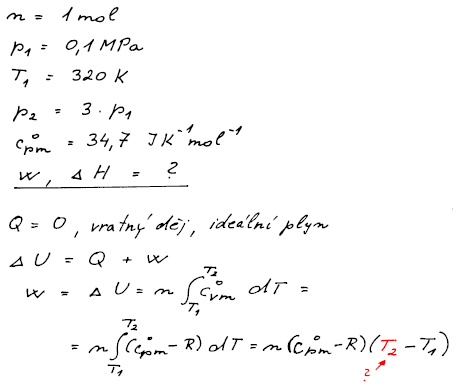
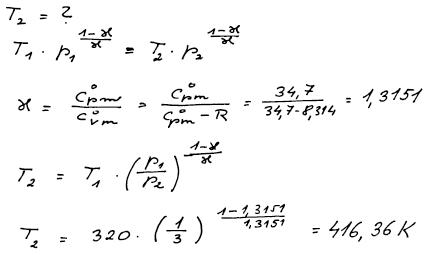
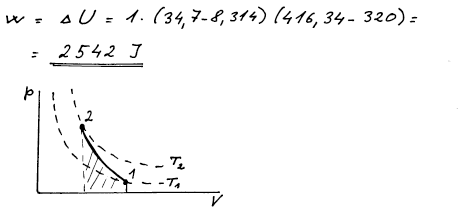
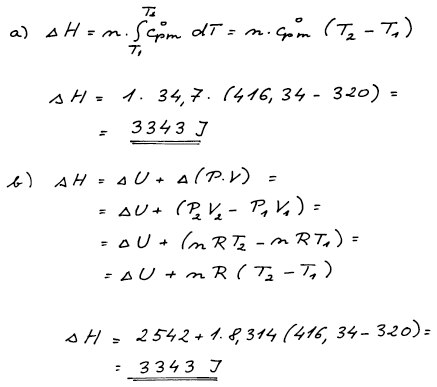
Při adiabatickém ději nevyměňuje systém s okolím teplo. Z 1. věty
termodynamické plyne, že práce je rovna změně vnitřní energii. Změnu
vnitřní energie umíme počítat z její teplotní závislosti. Při výpočtu
potřebujeme znát teplotu v bodě 2.
K výpočtu T2 můžeme využít Poissonovy rovnice. Ty je možno využít jen
je-li adiabatický děj vratný, systém obsahuje ideální plyn, vyměňuje
jen objemovou práci a tepelné kapacity Cp a CV nezávisí na teplotě.
Zakreslíme-li adiabatický děj do p–V diagramu, práce je vyznačena
jako plocha pod křivkou vyjadřující cestu systému z bodu 1 do bodu 2
tj. pod adiabatou mezi body 1 a 2.
Pro výpočet změny entalpie můžeme využít buď a) její teplotní
závislost nebo b) její definici.