1.3.6 Změna entalpie
Vypočtěte změnu entalpie spojenou se zahřátím 2 molů hliníku z 0 °C na
800 °C, je-li dáno:
ttání = 660 °C
ΔtáníHm = 9,78 kJ/mol
Cp,m°(Al,l) = 29,3 J K−1 mol−1
Cp,m°(Al,s) = 23,1 J K−1 mol−1
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ΔH = 58,3 kJ
Postup
Změna entalpie je součtem tepel potřebných o ohřívání a roztavení.
Audio
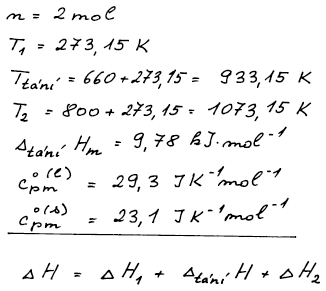
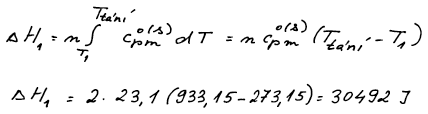
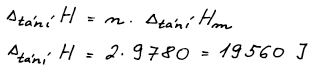
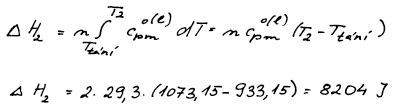
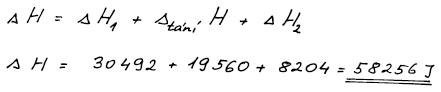
Entalpie je stavová veličina a její změna závisí jen na počátečním a
konečném stavu, nikoli na cestě mezi těmito stavy. Celkovou změnu
entalpie neumíme spočítat přímo, ale musíme si celkový děj rozdělit
na několik dílčích dějů, které spočítat umíme.
Změna entalpie související s ohřevem tuhého hliníku z 0 °C na teplotu
tání
Změna entalpie při tání hliníku
Změna entalpie doprovázející ohřev kapalného hliníku z teploty 660 °C na konečnou teplotu 800 °C
Výsledek získáme jako součet změn entalpií všech dílčích dějů, které
postupně vedou z počátečního stavu do stavu konečného.