1.3.8 Kirchhoffova věta
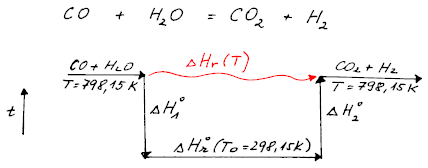
Vypočtěte teplo, které musí vyměnit reaktor s okolím, probíhá-li v něm při teplotě 798,15 K za konstantního tlaku reakce
![]()
Výchozí látky vstupují do reaktoru předehřáty na 798,15 K a produkty odcházejí z reaktoru se stejnou teplotou. Při výpočtu použijte dat uvedených v tabulce.

↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ΔH = −36.32 kJ/mol
Postup
Nejprve spočteme změnu entalpie z Hessova zákona. Pak ji přepočteme na zadanou teplotu podle Kirchhoffova vzorce.
Audio
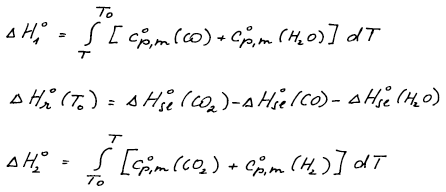
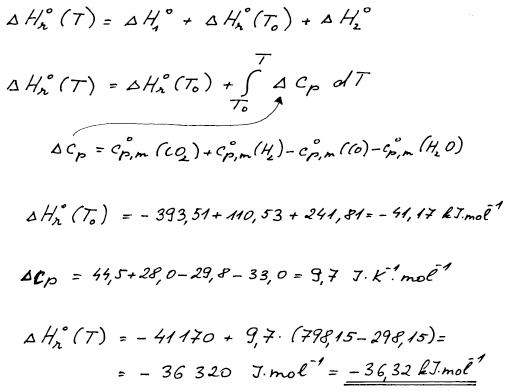
Z dostupných dat slučovacích entalpií umíme pomocí Hessova zákona
vypočítat reakční entalpii uvedené reakce při teplotě T0 = 298
K. Naším úkolem je však spočítat reakční entalpii při jiné teplotě T = 798,15 K. K tomu nám poslouží Kirchhoffův zákon – myšlenkově si celý
děj rozdělíme na 3 části: nejprve ochladíme výchozí látky z T na T0
(ΔH1°),
pak necháme látky zreagovat při teplotě T0 (ΔHr°(T0)), a
nakonec produkty reakce ohřejeme z T0 na T
(ΔH1°).
Výsledná reakční entalpie při teplotě T bude dána součtem
entalpiívšech třech dílčích kroků. Reakční entalpii při teplotě T0
vypočteme pomocí Hessova zákona, změny entalpie doprovázející
ochlazení a ohřátí z teplotní závislosti entalpie za konstantního
tlaku.
Součtem entalpií všech tří dílčích kroků a po úpravě výrazu získáme
pro reakční entalpii při teplotě T kondenzovaný vztah, který je
označován jako Kirchhoffův zákon, kde ΔrCp
je zkrácený zápis pro rozdíl
molárních tepelných kapacit produktů a výchozích látek násobených
příslušnými stechiometrickými koeficienty.