1.9.3 Reakce druhého řádu
Reakce
![]()
se řídí rychlostní rovnicí druhého řádu s rychlostní konstantou k = 7 . 10−4 dm3 mol−1 s−1. Vypočítejte poločas reakce a čas potřebný na změnu koncentrace látky A z 0,260 mol dm−3 na 0,011 mol dm−3.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
poločas = 1,53 hod
čas (0,260 mol dm−3 → 0,011 mol dm−3) = 34,5 hod
Postup
Použijeme integrovaný tvar kinetické rovnice kτ = 1/c−1/c0.
Audio
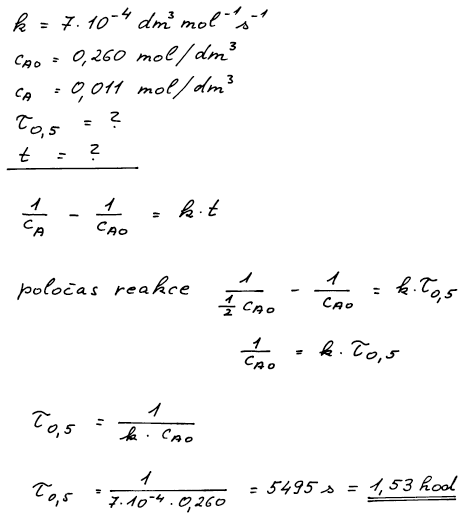
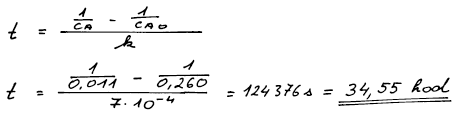
Výpočet vychází z integrovaného tvaru kinetické rovnice druhého
řádu. Pro výpočet poločasu reakce je třeba dosadit okamžitou
koncentraci látky A rovnající se polovině původní koncentrace.
K výpočtu času potřebného k dosažení určité koncentrace složky A,
známe-li její počáteční koncentraci, využijeme opět integrovanou
kinetickou rovnici druhého řádu. Pouhým dosazením zadaných údajů
zjistíme hledaný čas t.