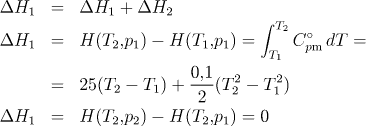3.1.12 Výpočet změny entalpie při kombinaci ohřátí a izotermního děje
Systém obsahující 1 mol ideálního plynu byl zahřát z teploty
300 K na teplotu 500 K a poté izotermně stlačen na tlak 5 MPa.
Počáteční tlak byl 0,2 MPa. Vypočtěte změnu entalpie. Teplotní
závislost tepelné kapacity plynu vystihuje rovnice
C°pm = 25+0,1 T J mol−1 K−1. (Nevíme, zda ohřátí bylo provedeno
izochoricky či izobaricky a nevíme ani, zda byl děj vratný!)
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓