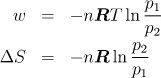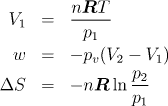4.1.11 Izotermní vratná a nevratná expanze ideálního plynu
Jeden mol ideálního plynu expandoval izotermně z tlaku 1 MPa na tlak 0,1 MPa při teplotě T=300 K. Vypočtěte teplo, práci a změnu entropie při tomto ději za předpokladu, že proběhl: a) vratně, b) nevratně proti vnějšímu tlaku 0,1 MPa.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓