4.1.14 Změna entropie při adiabatické expanzi ideálního plynu
 Dva moly ideálního plynu expandují adiabaticky z objemu V1 = 1
dm3 do vakua. Vypočítejte změnu entropie pro případ, kdy
v konečném stavu má plyn objem V2 = 10 dm3. Dokažte, že tato
expanze je nevratná. Výsledek porovnejte s případem, kdy expanze
probíhá vratně.
Dva moly ideálního plynu expandují adiabaticky z objemu V1 = 1
dm3 do vakua. Vypočítejte změnu entropie pro případ, kdy
v konečném stavu má plyn objem V2 = 10 dm3. Dokažte, že tato
expanze je nevratná. Výsledek porovnejte s případem, kdy expanze
probíhá vratně.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ΔSirev = 38,3 J K−1
ΔSrev = 0
Řešení
Při adiabatické expanzi ideálního plynu do vakua se nekoná žádná objemová práce, ani nedochází k výměně tepla s okolím. Jelikož dW = 0 a dQ = 0, musí podle I. věty termodynamiky platit dU = 0 a v důsledku toho i dT = 0, neboť C°Vm má konečnou kladnou hodnotu. Podle rovnice (4.9) platí
![]()
a tak při konstantní teplotě je
![]()
Jelikož V2 > V1, je ΔS > 0. Protože děj probíhá v izolovaném systému a entropie při něm vzrůstá, je podle II. věty termodynamiky nevratný.
V případě vratné adiabatické expanze platí Poissonova rovnice
![]()
Po dosazení do vztahu (4.9) dostaneme
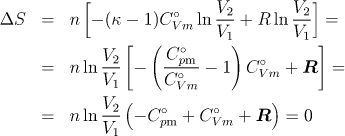
(platí Mayerův vztah mezi C°pm a C°Vm). Tento výsledek také dostaneme přímo z rovnice (4.1), protože při adiabatickém ději je teplo nulové.