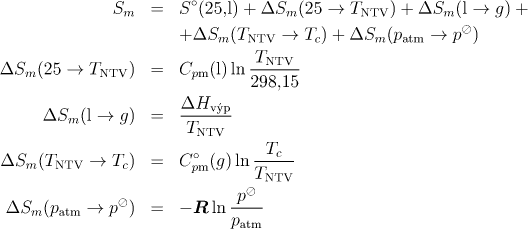4.1.21 Přepočet entropie látky na jiný stav
Vypočtěte absolutní molární entropii vody v následujících stavech:
a) H2O(s) při teplotě ta = −50 °C,
b) vodní páry při teplotě tb = 150 °C a tlaku 101,32 kPa,
c) nasycené vodní páry při teplotě tc = 120 °C.
U vodní páry
předpokládejte platnost stavové rovnice ideálního plynu a
použijte střední molární tepelnou kapacitu.
Molární tepelná kapacita ledu je 37,84 J mol−1 K−1, tlak nasycené vodní páry za
teploty 120 °C je 197,3 kPa. Při výpočtu využijte absolutní
entropii kapalné vody při teplotě 25 °C. Její hodnotu a ostatní
potřebné údaje nalezněte v tabulkách.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
a) Sm = 33,6 J mol−1 K−1 b) Sm = 200,0 J mol−1 K−1 c) Sm = 192,3 J mol−1 K−1
Postup
Tento děj rozdělíme do několika dílčích vratných pochodů
(viz příklad 4.1.19). Normální teplotu tání označíme
symbolem TNTT a normální teplotu varu symbolem TNTV.
Použijte tyto rovnice:
a)
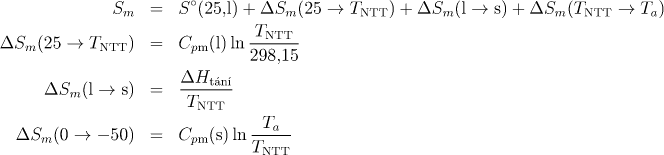
b)
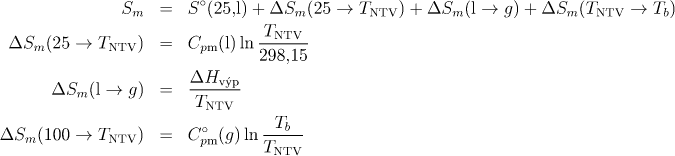
c)