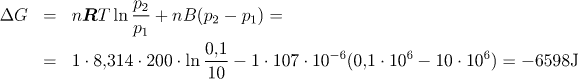4.2.1 Změna Gibbsovy energie s tlakem při izotermickém ději
Vypočítejte změnu Gibbsovy energie při izotermické expanzi 1 mol
methanu z tlaku 10 MPa na 0,1 MPa při teplotě 200 K. K výpočtu
použijte:
a) stavovou rovnici ideálního plynu,
b) viriální stavovou rovnici pVm = RT+Bp, kde B je druhý
viriální koeficient, který pro uvažovanou teplotu nabývá hodnoty
−107 cm3/mol.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ΔG(id) = −7657 J ΔG(vir) = −6598 J
Řešení
Totální diferenciál stavové funkce G = G(T,p) je vztahem (4.13)
![]()
Pro konečnou změnu Gibbsovy energie plynu při izotermickém ději platí vztah (4.16)
![]()
Po dosazení za objem ze stavové rovnice ideálního plynu a po má po integraci získáme hodnotu
![]()
Při aplikaci viriální rovnice ve spojení se vztahem (4.16) po integraci platí