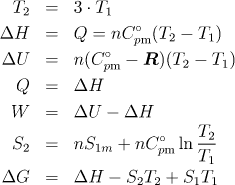4.2.3 Změna termodynamických funkcí při izobarickém ohřevu
Pět molů oxidu uhelnatého bylo z počátečního stavu 250 °C a 101,32 kPa zahříváno izobaricky vratně až objem systému dosáhl trojnásobku původního objemu. Vypočítejte ΔU, ΔH, Q, W, ΔS, ΔG tohoto pochodu. Molární entropie oxidu uhelnatého za teploty 250 °C a tlaku 101,325 kPa je 250 J mol−1K−1. Oxid uhelnatý se chová jako ideální plyn. Při výpočtu použijte střední molární kapacitu oxidu uhelnatého, kterou naleznete v tabulkách.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓