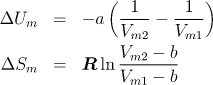4.4.5 Změna U, S, F při izotermní expanzi
Vypočtěte změnu molární vnitřní energie, entropie a Helmholtzovy
energie odpovídající
izotermní expanzi oxidu uhličitého z objemu
0,5 dm3mol−1 na objem 5 dm3mol−1 za teploty 340 K. Výpočet proveďte:
a) Za předpokladu, že plyn se
řídí van der Waalsovou rovnicí.
b) S využitím Redlichovy-Kwongovy stavové rovnice. V tomto případě využijte
tabulky kritických veličin a výpočet proveďte pomocí systému MAPLE.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓