5.6.1 Výpočet středních aktivitních koeficientů elektrolytu pomocí limitního Debyeova-Hückelova zákona
Vypočítejte pomocí Debyova-Hückelova vztahu střední aktivitní koeficient
chloridu draselného eventuálně síranu hlinitého při teplotě
25 °C u vodných roztoků:
a) chloridu draselného o molalitě 0,001 mol/kg,
b) chloridu draselného o molalitě 0,001 mol/kg,
který ještě obsahuje 0,001 mol/kg NaCl,
c) chloridu draselného v roztoku o molalitě 0,001 mol/kg,
který dále obsahuje 0,0005 mol/kg CuSO4,
d) síranu hlinitého v roztoku o molalitě 0,0001 mol/kg.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
a) ![]() b)
b) ![]() c)
c) ![]() d)
d) ![]()
Postup
Řešení
Pro střední aktivitní koeficienty elektrolytů ve zředěných
roztocích platí Debyeův-Hückelův limitní zákon (5.81)
s parametrem A = 1,1762 mol−1/2/kg1/2) .
a) Pro iontovou sílu podle (5.80) platí
![]()
a dosazením do Debyeova-Hückelova zákona (5.81) dostaneme střední aktivitní koeficient:
![]()
b) V tomto případě musíme zahrnout do výpočtu iontové síly všechny ionty, vzniklé disociací obou sloučenin. Tedy platí
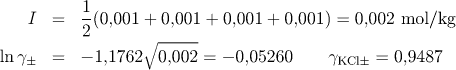
c) I v tomto případě je nutné zahrnout do výpočtu iontové síly všechny ionty přítomné v roztoku, přestože síran mědnatý zde působí jen jako indiferentní elektrolyt. Platí tedy
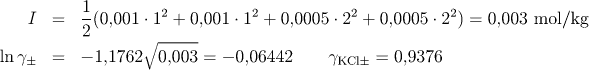
d) Při výpočtu iontové síly síranu hlinitého je třeba vzít v úvahu, že při disociaci této soli vzniká různý počet aniontů a kationtů a molality iontů v roztoku nejsou proto rovny molalitě rozpuštěné látky. Disociace probíhá podle rovnice
![]()
a
![]()
Iontová síla má proto hodnotu
![]()
a pro střední aktivitní koeficient dostaneme
![]()