5.6 Termodynamický popis roztoků elektrolytů
Chemický potenciál silného elektrolytu KνKAνA(2)
vyjadřujeme pomocí středního chemického potenciálu elektrolytu ![]() anebo
chemických potenciálů vzniklých iontů
anebo
chemických potenciálů vzniklých iontů
![]()
(ν = νK+νA),
které však nejsou přímo experimentálně dostupné na rozdíl od středního chemického
potenciálu elektrolytu. Chemické potenciály iontů jsou však za určitých
aproximací zjistitelné teoreticky. Místo nich se právě zavádí jejich aritmetický
průměr - střední chemický potenciál ![]() .
.
Při popisu termodynamického chování elektrolytů budeme jako koncentrační proměnnou používat molalitu a standardní stav nekonečného zředění. V analytické chemii se místo molality používá obvykle molarita. Numerické rozdíly mezi příslušnými hodnotami u vodných roztoků při nízkých koncentrací v teplotním rozsahu 15 až 25 °C jsou zanedbatelné.
Podobný postup jako u chemických potenciálů se aplikuje také pro molalitu, aktivitu a aktivitní koeficient (aritmetický průměr použitý pro chemický potenciál však vede ke geometrickému průměru u těchto veličin).
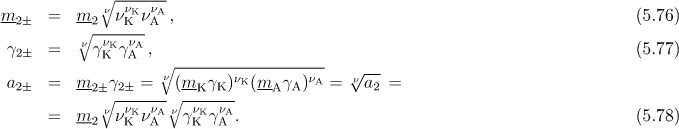
Z Debyeovy-Hückelovy teorie vyplývá, že pro velmi nízké molality mi < 0,001 je možno aktivitní koeficient iontu vypočítat ze vztahu
![]()
kde γi je aktivitní koeficient iontu, zi jeho nábojové číslo. A je konstanta, která pro vodu při 25 °C má hodnotu A = 1,1762 (kg/mol)0,5. Veličina I se označuje jako iontová síla a je dána relací
![]()
a součet se provádí přes všechny ionty v roztoku. Pro střední aktivitní koeficient ze vztahu (5.77) a (5.79) dostaneme
![]()
Pro vyšší koncentrace se používají závislosti komplikovanější a jednou z nich je Daviesův vztah
![]()
který je možno používat do I < 0,1 mol/kg. Průměrná hodnota parametru B je 0,3 kg/mol.
Příklady:
5.6.1 Výpočet středních aktivitních koeficientů elektrolytu pomocí limitního Debyeova-Hückelova zákona (5.6.2 Aplikace Debyeova-Hückelova zákona (
5.6.3 Relace mezi střední aktivitou a středním aktivitním koefientem u elektrolytu (
5.6.4 Výpočet středního aktivitního koeficientu u roztoku dvou elektrolytů (