6.1.44 Entalpická bilance v soustavě s chemickou rovnováhou
Esterifikace kyseliny octové ethanolem probíhá v plynné fázi při teplotě 500 K a atmosférickém tlaku. Suroviny vstupují do reaktoru předehřáty na teplotu 450 K. Vypočítejte, kolik tepla se uvolní při zpracování jednoho molu kyseliny, je-li esterifikace prováděna teoretickým množstvím ethanolu. Dále vypočítejte, jaký přebytek ethanolu musíme zvolit, aby reakce probíhala adiabaticky. Rovnovážná konstanta esterifikace má při teplotě 500 K hodnotu 8,7 pro standardní stav f° = 101,325 kPa všech látek.Potřebná data vyhledejte v tabulkách .
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
![]()
K adiabatickému průběhu reakce dochází, je-li v nástřiku poměr ethanolu vůči kyselině buď 0,4127:1 nebo 2,3923:1. Úloha má dvě reálná řešení.
Postup
Změna entalpie při reakci za teploty 500 K je dána teplem spotřebovaným na ohřev suroviny z teploty 450 K na teplotu reakce a teplem uvolněným při samotné reakci. Při esterifikaci jednoho molu ethanolu a jednoho molu kyseliny se uvolní pouze část reakční entalpie, protože reakce neproběhne úplně.
![]()
Přebytek ethanolu nutný pro adiabatický průběh reakce určíme ze simultánního řešení látkové a entalpické bilance daného děje, kde a představuje látkové množství ethanolu vstupujícího do reakce:
![]()
![]()
Řešení
Termochemická data najdeme v tabulkách :

Nejdříve vypočítáme teplo, které se uvolní při esterifikaci stechiometrickým množstvím ethanolu. Změna entalpie při reakci za teploty 500 K je dána dvěma složkami: teplem spotřebovaným na ohřev suroviny z teploty 450 K na teplotu reakce a teplem uvolněným při samotné reakci. Při esterifikaci jednoho molu ethanolu a jednoho molu kyseliny se uvolní pouze část reakční entalpie, protože reakce neproběhne úplně. Použijeme-li rozsah reakce ξ, je uvolněné teplo dáno vztahem
![]()
kde ΔH1 je teplo, spotřebované na ohřev jednoho molu kyseliny octové a ΔH2 - teplo spotřebované na ohřev jednoho molu ethanolu. Vypočítáme jednotlivé změny entalpie:
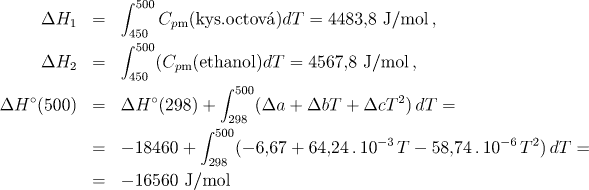
Nyní vypočítáme rozsah reakce při stechiometrickém nástřiku. V reaktoru probíhá reakce
![]()
Látkovou bilanci uspořádáme do tabulky:

![]()
Po úpravě vypočítáme rozsah reakce podle vztahu
![]()
Teplo uvolněné při stechiometrickém nástřiku se tedy vypočítá z relace (6.8)
![]()
Toto teplo je vztaženo na jeden mol kyseliny octové vstupující do reaktoru; z tohoto látkového množství zreaguje pouze 74,68 %. Proto má uvolněné teplo, připadající na jeden mol zreagované kyseliny octové, hodnotu
![]()
Nyní vypočítáme přebytek ethanolu, nutný k adiabatickému průběhu reakce. Pro obecné složení nástřiku platí látková bilance, uvedená v tabulce:

![]()
z něhož po úpravě získáme pro ξ kvadratickou rovnici
![]()
Tato rovnice obsahuje látkové množství ethanolu a, které neznáme. Druhou rovnicí je bilance entalpie, která má nyní tvar
![]()
neboť reakce probíhá adiabaticky. Po dosazení dostaneme
![]()
a po úpravě máme druhý vztah mezi proměnnými ξ, a:
![]()
Po úpravě a dosazení do vztahu (6.9) dostaneme kvadratickou rovnici
![]()
z níž plynou dva kořeny:
![]()
Oba tyto kořeny mají fyzikální význam, neboť rozsah reakce je v daném případě od nuly do jedné. Odpovídající látková množství ethanolu v nástřiku jsou
![]()
K adiabatickému průběhu reakce tedy dochází, je-li v nástřiku poměr ethanolu vůči kyselině buď 0,4127:1 nebo 2,3923:1. Úloha má dvě reálná řešení, což plyne z následující úvahy. Při malém množství ethanolu v nástřiku probíhá reakce jen z malé části a uvolní se málo tepla, takže k dosažení teploty 500 K je nutno směs ohřívat. Naopak při velkém přebytku ethanolu, vstupujícího do reaktoru při nižší teplotě, než při které reakce probíhá, působí ethanol zčásti jako inert a uvolněné teplo jej nestačí ohřát.