6.2.13 Rozpustnost málo rozpustné soli
Součin rozpustnosti Pb3(PO4)2 má při teplotě 25 °C hodnotu 1,5.10−32 (standardní stav c° = 1
mol/dm3). Vypočítejte rozpustnost fosforečnanu olovnatého
při 25°C v:
1. čisté vodě,
2. roztoku dusičnanu olovnatého o koncentraci 0,01 mol/dm3,
3. roztoku fosforečnanu sodného o koncentraci 0,01 mol/dm3,
4. roztoku síranu sodného o koncentraci 0,01 mol/dm3,
Předpokládejte, že ani jeden z iontů Pb2+ a PO43− nehydrolyzuje.
Výpočet proveďte ve všech případech:
a) za předpokladu, že aktivitní koeficienty jsou rovny jedné,
b) s aktivitními koeficienty vypočtenými pomocí Debyeova-Hückelova
limitního vztahu (A = 1,1762 dm3/2/mol1/2).
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
Vše v mol/dm3:
1a) 1,693 . 10−7, 1b) 1,712 . 10−7
2a) 6,124 . 10−14, 2b) 1,301 . 10−12
3a) 1,771 . 10−10, 3b) 3,159 . 10−9
4a) 1,693 . 10−7, 4b) 5,747 . 10−7
Poznámka: Příklad je velmi nerealistický, protože ve skutečnosti
ionty (především PO43−) hydrolyzují. Skutečné rozpustnosti jsou
několikanásobně vyšší.
Řešení
Veškerý fosforečnan olovnatý, který se rozpustí, disociuje podle rovnice
![]()
Pro součin rozpustnosti fosforečnanu olovnatého platí
![]()
kde c° je standardní koncentrace.
1. Rozpustnost fosforečnanu olovnatého v čisté vodě
Zanedbáme-li hydrolýzu (viz poznámka na konci), budou
v roztoku přítomny pouze ionty Pb2+ a PO43−, které
pocházejí pouze z fosforečnanu olovnatého. Ze stechiometrie
reakce (6.44) plyne
![]()
a
![]()
![]()
Pro rozpustnost fosforečnanu olovnatého v čisté vodě platí
![]()
a) Pro případ ideálního roztoku (![]() = 1) je
= 1) je
![]()
Tuto hodnotu označíme jako c1.
b) Výpočet pro neideální roztok.
Pro výpočet středního aktivitního koeficientu použijeme limitního
Debyeova-Hückelova vztahu. Iontovou sílu vypočteme pomocí
hodnoty rozpustnosti c1:
![]()
a pak podle Debyeova-Hückelova zákona
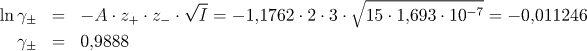
a pro rozpustnost fosforečnanu olovnatého v tomto případě platí
![]()
Hodnota c2, při jejímž výpočtu jsme brali v úvahu neidealitu
roztoku, se od hodnoty c1 pro ideální roztok liší jen o 1,1 %
a z tohoto důvodu ani nemusíme provádět další iterační krok
s touto novou koncentrací.
2. Rozpustnost fosforečnanu olovnatého
v roztoku dusičnanu olovnatého
Fosforečnan olovnatý i dusičnan olovnatý jsou ve vodném roztoku
zcela disociovány:
![]()
Pro koncentrace jednotlivých iontů platí
![]()
Protože ![]() , je možno přibližně psát
, je možno přibližně psát
![]() . Za koncentrace
olovnatého a fosforečnanového iontu dosadíme do vztahu
(6.45) pro součin rozpustnosti
. Za koncentrace
olovnatého a fosforečnanového iontu dosadíme do vztahu
(6.45) pro součin rozpustnosti
![]()
Pro rozpustnost fosforečnanu olovnatého v roztoku dusičnanu olovnatého platí

a) Výpočet za předpokladu ideálního roztoku (![]() = 1)
= 1)
![]()
b) Pro výpočet středního aktivitního koeficientu opět použijeme limitního Debyeova-Hückelova vztahu. Pro iontovou sílu v tomto případě platí
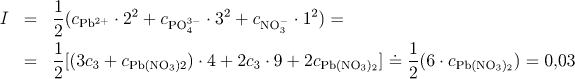
(c3 je opět možno proti cPb(NO3)2 zanedbat). Pak
![]()
Tuto hodnotu aktivitního koeficientu dosadíme do vztahu (6.51)
![]()
V tomto případě způsobí předpoklad ideálního chování řádovou
chybu ve vypočtených hodnotách rozpustnosti.
3. Rozpustnost fosforečnanu olovnatého
v roztoku fosforečnanu sodného
Fosforečnan olovnatý i fosforečnan sodný jsou ve vodném roztoku
zcela disociovány:
![]()
Pro koncentrace jednotlivých iontů zde platí
![]()
Také zde je možno předpokládat, že ![]() a
a ![]() Za koncentrace olovnatého a fosforečnanového iontu dosadíme do
vztahu (6.45) pro součin rozpustnosti
Za koncentrace olovnatého a fosforečnanového iontu dosadíme do
vztahu (6.45) pro součin rozpustnosti
![]()
Pro rozpustnost fosforečnanu olovnatého v roztoku fosforečnanu sodného platí
![]()
a) Výpočet za předpokladu ideálního roztoku (![]()
![]()
b) Pro výpočet středního aktivitního koeficientu opět použijeme
limitního Debyeova-Hückelova vztahu.
Iontová síla bude rovna
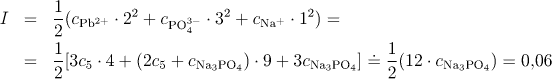
(c5 je možno proti cNa3PO4 zanedbat). Pak
![]()
Tuto hodnotu aktivitního koeficientu dosadíme do vztahu (6.55)
![]()
4. Rozpustnost fosforečnanu olovnatého
v roztoku síranu sodného
a) Výpočet za předpokladu ideálního chování
Síran sodný nemá s fosforečnanem olovnatým žádné společné
ionty. Koncentrace iontů Pb2+ a PO43− není proto
přítomností síranu sodného ovlivněna a jeho vliv se projevuje
pouze v hodnotě středního aktivitního koeficientu. Pro
![]() = 1 je tedy hodnota rozpustnosti fosforečnanu
olovnatého v roztoku síranu sodného stejná jako hodnota
rozpustnosti této soli v čisté vodě
= 1 je tedy hodnota rozpustnosti fosforečnanu
olovnatého v roztoku síranu sodného stejná jako hodnota
rozpustnosti této soli v čisté vodě
![]()
b) Iontová síla je dána vztahem
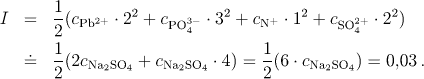
Střední aktivitní koeficient bude mít hodnotu
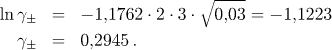
Pro rozpustnost fosforečnanu olovnatého v tomto případě platí
![]()
Hodnota rozpustnosti Pb3(PO4)2 ve vodném roztoku síranu sodného o koncentraci 0,01 mol/dm3 je více než 3 krát větší než v případě, kdy Pb3(PO4)2 je rozpuštěn v čisté vodě. Tento efekt, kdy přídavek indiferentního elektrolytu zvýší rozpustnost málo rozpustné soli ve vodě, se označuje jako vsolovací.
Poznámka: Při výpočtech jsme nezahrnuli vliv hydrolýzy iontů. To se týká především PO43−, který hydrolyzuje podle rovnice PO43−+H2O → PO42−+OH−, čímž se roztok stane zásaditým a rozpustnost stoupne. Uvažujeme-li pouze hydrolýzu PO43−, vyjde rozpustnost v čisté vodě za předpokladu jednotkových aktivit 3,7 . 10−6 mol dm−3, tj. dvacetkrát vyšší. Rozpustnost bude ovlivněna i v dalších případech. Tyto výpočty jsou však již mimo rámec tohoto úvodního textu.