7.1.7 Převodová čísla
V Hittorfově přístroji s inertními elektrodami byl
elektrolyzován 0,1 molální roztok chloridu lanthanitého.
Po skončení elektrolýzy vážil katodový roztok 52
g a obsahoval 1,1 g LaCl3. Během pokusu se na anodě
vyvinulo 39,4 cm3 chloru (měřeno při teplotě 22 °C a tlaku 98,1 kPa).
a) Stanovte převodová čísla iontů La3+ a Cl−.
b) Vypočítejte molalitu LaCl3 v anodovém roztoku, který
po elektrolýze vážil 60 g.
c) Kolik cm3 roztoku kyseliny chlorovodíkové o koncentraci
0,25 mol/dm3 je třeba na neutralizaci katodového roztoku?
d) Kolik mědi se vyloučilo v sériově zapojeném coulometru
na měď?
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
ne = 3,15.10−3 mol
tA = 0,562 tK = 0,438
(mLaCl3)an = 0,092 mol kg−1
nLa(OH)3 = 1,05.10−3 mol
mCu = 0,104 g
Řešení
Na elektrodách probíhají děje:
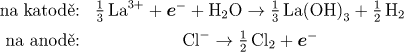
Projde-li elektrolytem náboj Q (podíl Q/F označíme symbolem
ne), vyloučí se podle Faradayových zákonů na katodě ne/zK
mol kationtů, na anodě ne/zA mol aniontů, migrací přejde
z katodového prostoru do anodového prostoru (ne . tA)/|zA|
mol aniontů a opačným směrem (ne . tK)/|zK| mol kationtů.
Změny koncentrace v katodovém a anodovém
prostoru zjistíme z následující bilance:
Katodový prostor (index kat):
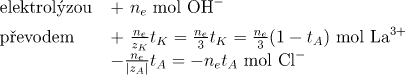
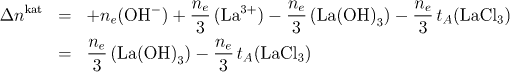
Anodový prostor (index an):
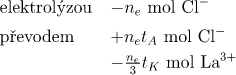
![]()
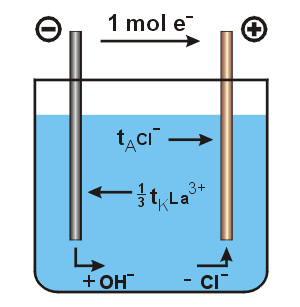
a) Výpočet převodových čísel
1. Výpočet změny koncentrace katodového roztoku
Z bilance (3) plyne, že látkové množství LaCl3
v katodovém prostoru se změnilo o
![]()
Látkové množství LaCl3 (M = 245,269 g mol−1) v katodovém prostoru před elektrolýzou vypočteme z molality (m2 = n2/m1; m1 je hmotnost vody). Za předpokladu, že změna hmotnosti katodového roztoku během elektrolýzy je zanedbatelná, tedy platí
![]()
odkud
![]()
Látkové množství LaCl3 v katodovém prostoru po elektrolýze
![]()
Pak
![]()
2. Stanovení ne – celkového náboje prošlého
elektrolytem
Náboj, který projde během pokusu elektrolytem, stanovíme
z množství chloru, vyvinutého na anodě. Při T = 295,15 K a p =
98,1 kPa bylo naměřeno V = 0,0394 dm3 chloru, tedy
![]()
Podle Faradayova zákona (pro Cl2 je |zA| = 2) je
![]()
Pak
![]()
3. Převodová čísla
Převodové číslo aniontu Cl− získáme dosazením
do rovnice pro změnu látkového množství LaCl3 v katodovém prostoru:
![]()
a pro převodové číslo kationtu La3+ platí
![]()
b) Výpočet molality anodového roztoku
Projde-li systémem ne = 3,15 . 10−3F, změní se
látkové množství soli v anodovém
roztoku, který má hmotnost 60 g, o hodnotu
![]()
odkud vypočteme látkové množství LaCl3 v anodovém roztoku po elektrolýze:
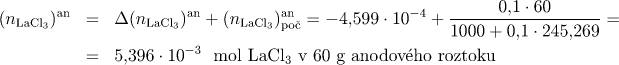
Pro molalitu anodového roztoku dostaneme
![]()
c) Neutralizace katodového roztoku Pro látkové množství La(OH)3, které vznikne v katodovém prostoru, z bilance plyne
![]()
Na jeho neutralizaci roztokem kyseliny chlorovodíkové o koncentraci 0,25 mol dm−3 je zapotřebí

d) Množství mědi vyloučené v sériově zapojeném
coulometru na měď
Roztokem prošlo n = Q/F = 3,15.10−3 mol. Podle Faradayova
zákona (7.3) platí
![]()