8.2.15 Výpočet času k určité konverzi u reakce II. řádu
Reakce A + B → R je reakcí II. řádu s k = 0,008
s−1 dm3 mol−1.
Jestliže počáteční koncentrace obou látek byly cA0 = 0,2 mol/dm3 a
cB0 = 0,1 mol/dm3, vypočtěte:
a) za jak dlouhou dobu poklesne koncentrace látky A na polovinu své
počáteční hodnoty,
b) za jak dlouhou dobu poklesne koncentrace látky B na polovinu své
počáteční hodnoty,
c) jaké koncentrace budou mít látky A,B a R v čase 500 s,
d) vypočtěte koncentraci produktu R v čase 500 s, jestliže jeho počáteční
koncentrace byla cR0 = 0,01 mol/dm3.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
a) τ = ∞, b) τ = 506,8 s, c) x = 0,0496 mol/dm3, cA = 0,1504 mol/dm3, cB = 0,0504 mol/dm3, cR = 0,0496 mol/dm3, d) cR = 0,0596 mol/dm3).
Postup
Úlohu a) až d) řešíme na základě relace (8.21) a látkové bilance.
Řešení
Průběh koncentrací látek A,B a R na čase je dán vztahy(8.21).
ad a) V tomto případě má platit cA = cA0/2 = 0,1 mol/dm3
(x = 0,1 mol/dm3). Koncentrace
látky B se musí rovněž snížit o 0,1 mol/dm3 a tudíž
cB = 0 a to je možné až v nekonečně velkém čase.
ad b) Klesne-li koncentrace látky B na hodnotu
cB = (1/2)cB0 = 0,05
mol/dm3 (x = 0,05 mol/dm3), sníží se koncentrace látky A na
0,2-0,05=0,15 mol/dm3. Dosazením do prvního vztahu (8.16) získáme
![]()
ad c) Nejdříve si vypočteme x dosazením do druhého vztahu (8.21)
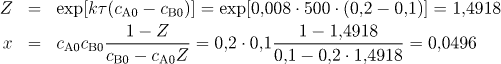
a koncentrace jednotlivých látek bude rovna
cA = cA0−x = 0,1504 mol/dm3,
cB = 0,0504 mol/dm3,
cR = 0,0496 mol/dm3.
ad d) Koncentrace látky R v tomto případě bude
cR = cR0+x = 0,0596 mol/dm3.