3.12 Kinetika reakce nultého řádu 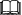
Na obrázku je naznačena závislost koncentrace výchozí látky A na čase pro reakci nultého řádu. Do obrázku naznačte analogickou závislost pro případ, že reakce bude probíhat s dvojnásobnou rychlostní konstantou. Uvažujte stejnou výchozí koncentraci.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
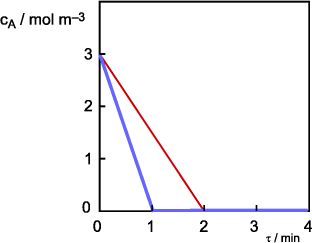
Řešení
Kinetickou rovnici pro nultý řád je možno napsat ve tvaru
![]()
Vyjádřeno slovy: Koncentrace látky A (v intervalu od cA,0 do 0) ubývá konstantní rychlostí.
Bude-li rychlostní konstanta dvojnásobná, bude směrnice závislosti
cA = f(τ) rovněž dvojnásobná a látka A "vyreaguje" za
poloviční čas.
Poznámka
Reakcí nultého řádu lze aproximovat odbourávání ethanolu
v lidském těle. Rychlostní konstanta reakce je úměrná hmotnosti
člověka. Stokilový chlap tedy vystřízliví zhruba za poloviční čas
než padesátikilová dáma (pokud oba popíjeli stejně).