6.2.4 Výpočet pH a disociačních parametrů roztoků kyselin a zásad I
V 1 litru vody bylo rozpuštěno 0,1 g mravenčí kyseliny. Vypočítejte pH tohoto roztoku. Při výpočtu použijte údajů z tabulek.
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
↓
Výsledek
pH = 3,207.
Postup
Slabá kyselina ve vodném roztoku částečně disociuje podle rovnice
![]()
Použijeme-li k vyjádření koncentrace iontů a nedisociované kyseliny v roztoku stupeň disociace α, definovaný výrazem
![]()
pak z bilance vychází, že
![]()
Pokud uvažujeme ideální chování a nepříliš koncentrované roztoky, je možno aktivitu vody považovat za jednotkovou a aktivity iontů a nedisociované kyseliny aproximovat koncentracemi. Pro disociační konstantu slabé kyseliny potom platí
![]()
odtud
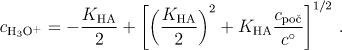
U slabých kyselin
s relativně malým stupněm disociace lze pro ![]() v rovnici pro KHA zanedbat koncentraci
disociovaného podílu proti původní koncentraci, takže
v rovnici pro KHA zanedbat koncentraci
disociovaného podílu proti původní koncentraci, takže ![]() a pro disociační konstantu lze pak psát
a pro disociační konstantu lze pak psát
![]()
a
![]()